Estimaciones que pueden
realizarse en los estudios
de cohortes
La diferencia de incidencias como medida del impacto potencial que tendría la eliminación de la exposición
La fracción o proporción atribuible o proporción de casos de una enfermedad que resulta de la exposición a un factor determinado o a una combinación de ellos
El riesgo relativo como medida de la magnitud de la asociación entre el factor de riesgo y la variable de respuesta.
La incidencia de la enfermedad en los sujetos expuestos y en los no expuestos
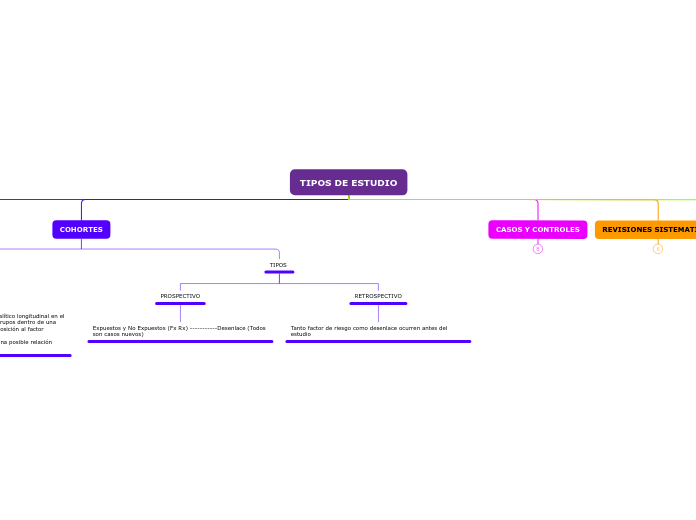
TIPOS DE ESTUDIO
OTROS DISEÑOS EXPERIMENTALES
OTROS
Subtopic
Ensayos controlados no aleatorios / Ensayos no controlados
Ensayo clínico factorial / Ensayo clínico cruzado / Ensayos comunitarios
Evaluación de la eficacia
de medidas preventivas. / Evaluación de la eficacia
de pruebas diagnósticas
Evaluación de tratamientos
no farmacológicos: Aproximadamente el 25% de los ensayos clínicos que se publican evalúan intervenciones no farmacológicas, como la cirugía, la rehabilitación, la psicoterapia, las terapias conductuales o las terapias alternativas.
Métodos Secuenciales. Se trata de ensayos en los que el tamaño de la muestra no está predeterminado, sino que
depende de las observaciones que se realizan. Su característica principal es la definición de una regla de
finalización explícita en la que se establece la forma
en que la decisión de finalizar el estudio depende
de los resultados obtenidos hasta ese momento
Desarrollo clínico
de medicamentos
Desarrollo
Clínico
Pequeña escala / Seguridad / 1 año /Sujetos voluntarios sanos
Mayor escala / Eficacia Terapéutica / 100 a 300 voluntarios / 2 años
Fase de la evaluación de un medicamento antes de su comercialización
Evaluar la eficacia y relación beneficio/riesgo en comparación con otras alternativas terapéuticas disponibles, o con un placebo si no hay tratamiento disponible. Permite establecer la eficacia del nuevo fármaco e identificar y cuantificar los efectos indeseables más frecuentes. /1.000 a 3.000 individuos /3 años / Ensayos clínicos aleatorios
Estudios realizados después de la comercialización del fármaco /Pacientes
Investigación PreClinica
Durante la cual se realizan estudios de laboratorio y en animales para demostrar la actividad biológica del compuesto en una determinada enfermedad y evaluar su seguridad. / 3 años y medio
REVISIONES SISTEMATICAS
Una revisión sistemática (RS) de la evidencia científica consiste en la síntesis de la mejor evidencia disponible para responder a una pregunta concreta mediante la aplicación de una metodología explícita y rigurosa.
Definición del objetivo
La finalidad de una RS es intentar responder una
pregunta clínica concreta valorando todas las pruebas
disponibles procedentes de las investigaciones realizadas.
Criterios de selección
Los estudios identificados forman la población
candidata. La selección de los que se incluirán en
la RS debe hacerse a partir de criterios explícitos y
establecidos con claridad, de forma que el proceso
sea reproducible por otros investigadores.
Valoración crítica de los estudios seleccionados
Idealmente, sólo deberían incluirse en una RS aquellos estudios con una calidad mínima suficiente, establecida de antemano, para asegurar que sus resultados puedan considerarse válidos.
Fases de la estrategia de análisis de una revisión sistemática • Decidir si es adecuado realizar una integración
de los estudios
• Decidir qué comparaciones se van a hacer
• Analizar la heterogeneidad de los estudios
(tablas de evidencias, pruebas estadísticas,
métodos gráficos)
• Si es adecuado, calcular un estimador global
del efecto (metaanálisis) con su intervalo
de confianza
• Presentación gráfica de los resultados
• Análisis de subgrupos
• Análisis de sensibilidad:
– Para evaluar la robustez del resultado
– Para explorar la heterogeneidad de los estudios
• Evaluar la existencia de un posible sesgo
de publicación
• Pruebas para detectar diferencias sistemáticas
entre estudios
SESGOS: Sesgo de publicación, en la localización de estudios, del idioma inglés, de las bases de datos, de citación, de publicación múltiple, datos ausentes o de mala calidad y en la definición de los criterios de inclusión
CASOS Y CONTROLES
VENTAJAS Y DESVENTAJAS
Ventajas
- Útiles para estudiar enfermedades poco
frecuentes
- Son un buen diseño para estudiar enfermedades
con largos períodos de latencia
- Permiten estudiar exposiciones poco frecuentes
siempre que estén asociadas a la enfermedad
- Pueden evaluar múltiples factores de riesgo
para una sola enfermedad
- Su duración es relativamente corta
Desventajas
- Es fácil que se introduzcan errores sistemáticos
tanto en la selección de los grupos como
al recoger la información
- En ocasiones es difícil establecer la secuencia
temporal entre la exposición y la enfermedad
- No son un buen diseño para estudiar más
de una enfermedad de forma simultánea
- No permiten calcular la incidencia o prevalencia
de la enfermedad
Se elige un grupo de individuos que tienen un efecto o una
enfermedad determinada (casos), y otro en el que
está ausente (controles). Ambos grupos se comparan respecto a la frecuencia de exposición previa a un factor de riesgo (factor de estudio) que se sospecha que está relacionado con dicho efecto o enfermedad.
Identificación de los casos. Una vez se ha elaborado una definición conceptual del caso, el siguiente paso es desarrollar una definición operativa para identificarlos.
Selección de los controles
La elección del grupo control es la clave de este tipo
de estudios, ya que debe ser comparable al de casos
(los controles deben tener la misma probabilidad de
haber estado expuestos que los casos). En realidad,
lo importante es que los controles sean representativos de la población de donde provienen los casos
Número de controles por caso.
Cuando existe un número de casos suficiente, se
suele seleccionar un control por cada uno, máximo 4:1
Número de grupos control. Para valorar la posibilidad de que se haya cometido un sesgo en la selección de los controles, algunos autores recomiendan, si es posible, utilizar dos grupos control.
COHORTES
TIPOS
RETROSPECTIVO
Tanto factor de riesgo como desenlace ocurren antes del estudio
PROSPECTIVO
Expuestos y No Expuestos (Fx Rx) -----------Desenlace (Todos son casos nuevos)
El término cohorte se utiliza para designar a un grupo
de sujetos que tienen una característica o un conjunto de características en común (generalmente la exposición al factor de estudio),
2 COHORTES: Diseño observacional analítico longitudinal en el que se comparan dos cohortes, o dos grupos dentro de una misma cohorte, que difieren por su exposición al factor
de estudio, con el objetivo de evaluar una posible relación causa-efecto
1 COHORTE: Cuando solamente existe una
cohorte que es seguida en el tiempo / incidencia o evolución, se trata de un diseño descriptivo longitudinal
ENSAYO CLINICO ALEATORIZADO
MUESTRA (Posterior a exclusiones o rechazos)
Asignación Aleatoria (Asegurar la comparabilidad de los grupos, de manera que la comparación
entre las intervenciones o tratamientos sea lo más
imparcial posible, tiende a producir una distribución equilibrada de las variables entre los grupos, tanto de las conocidas como de las que no lo son) y permite
la utilización de técnicas de ENMASCARAMIENTO, que
son muy útiles para obtener una estimación no sesgada de la variable de respuesta.
Grupo B
Intervención de Comparación (Placebo
Grupo A
Intervención de Estudio
ANALÍTICOS - PROSPECTIVOS
EL INVESTIGADOR CONTROLA EL FACTOR DE ESTUDIO
OBJETIVO
EVALUAR EFECTO
ESTABLECER CAUSA-EFECTO
QUE CONTROLA
FORMA (Dosis, duración)
INTERVENCION
SUJETOS