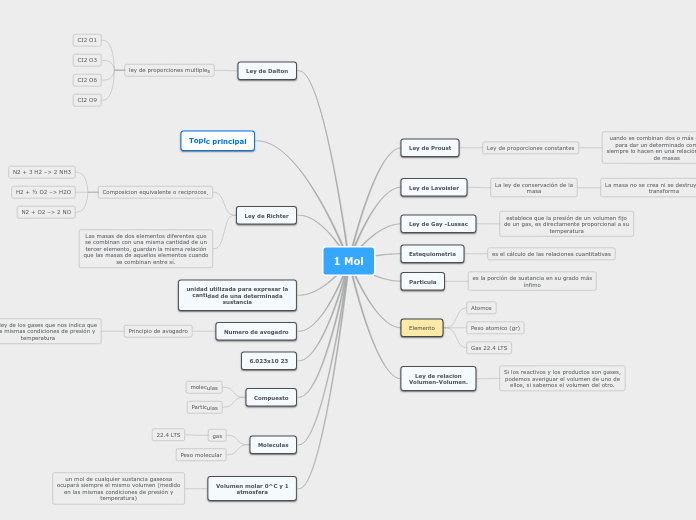
1 Mol
Ley de Proust
Ley de proporciones constantes
uando se combinan dos o más elementos
para dar un determinado compuesto,
siempre lo hacen en una relación constante
de masas
Ley de Lavoisier
La ley de conservación de la
masa
La masa no se crea ni se destruye, sólo se
transforma
NaCI ⇒ Na + Cl 2
NaCI ⇒ 2Na + Cl 2^ 2 NaCI = 2(23 + 35.5)
= 2 (58.5) = 117 g
2 Na=2X23=46g
C12 = 2 X 35.5 = 71 g
Ley de Gay -Lussac
establece que la presión de un volumen fijo
de un gas, es directamente proporcional a su
temperatura
Estequiometria
es el cálculo de las relaciones cuantitativas
Particula
es la porción de sustancia en su grado más
ínfimo
Elemento
Atomos
Peso atomico (gr)
Gas 22.4 LTS
Ley de relacion
Volumen-Volumen.
Si los reactivos y los productos son gases,
podemos averiguar el volumen de uno de
ellos, si sabemos el volumen del otro.
Ley de Dalton
ley de proporciones multiples
CI2 O1
CI2 O3
CI2 O6
CI2 O9
Topic principal
Ley de Richter
Composicion equivalente o reciprocos.
N2 + 3 H2 –> 2 NH3
H2 + ½ O2 –> H2O
N2 + O2 –> 2 NO
Las masas de dos elementos diferentes que
se combinan con una misma cantidad de un
tercer elemento, guardan la misma relación
que las masas de aquellos elementos cuando
se combinan entre sí.
unidad utilizada para expresar la
cantidad de una determinada
sustancia
Numero de avogadro
Principio de avogadro
es una ley de los gases que nos indica que
bajo las mismas condiciones de presión y
temperatura
6.023x10 23
Compuesto
moleculas
Particulas
Moleculas
gas
22.4 LTS
Peso molecular
Volumen molar 0^C y 1
atmosfera
un mol de cualquier sustancia gaseosa
ocupará siempre el mismo volumen (medido
en las mismas condiciones de presión y
temperatura)