Controle de la qualité par dosage
Qu'est-ce qu'un dosage par titrage direct
Montage permettant de réaliser un titrage direct

Réaction de support d'un titrage
un dosage par titrage direct est une technique de dosage mettant en jeu une réaction chimique. La réation de titrage doit être quantitative, c'est-à-dire totale, rapide et unique
Equivalence d'un titrage
L'équivalence d'un titrage est atteinte lorsqu'on a réalisé un mélange stoechiométrique du réactif titrant et du réactif titré. Les deux réactifs sont alors totalement consommés
Relations à l'équivalence d'un titrage
à l'équivalence: (no(a))/a=(ne(b))/b
soit (Ca.Va)/a=(Cb.Ve)/b
Qu'est-ce qu'un dosage par étalonnage
dosage par étalonnage

Réaliser un dosage par étalonnage consiste à déterminer la concentration d'une espèce en solution en comparant une grandeur physique, caractéristique de la solution, à la même grandeur physique mesurée pour des solutions étalon.
Dosage avec un spectrophotomètre
Loi de Beer-Lambert: L'absorbance A d'une espècechimique en solution diluée, est proportionnelle à la concentration molaire C de cette espèce:
A=K.C
A sans unité; C en mol/L; K en L/mol
dosage avec un conductimètre
Loi de Kohlrausch: la conductivité d'une solution diluée d'une espèce ionique dissoute est proportionnelle à sa concentration molaire en soluté apporté: °=K.C
) en S/m; C en mol/L; K en S.L/m/mol

Comment repérer l'équivalence d'un titrage direct
Cas d'un titrage par conductimétrie
Un titrage conductimétrique peut-être envisagé lorsque la réaction support du titrage fait intervenir des ions.
Si au cours d'un titrage conductimétrique la dilution est négligeable, le graphe )=f(Vréactif ajouté) est constitué de deux droites.
Le point d'intersection de ces droites permet de repérer l'équivalence du titrage

Cb=(Ca.Ve)/Vb
cas D'un titrage par ph-métrie
Un titrage pH-métrique peut être envisagé lorsque la réaction support du titrage est une réaction acido-basique.
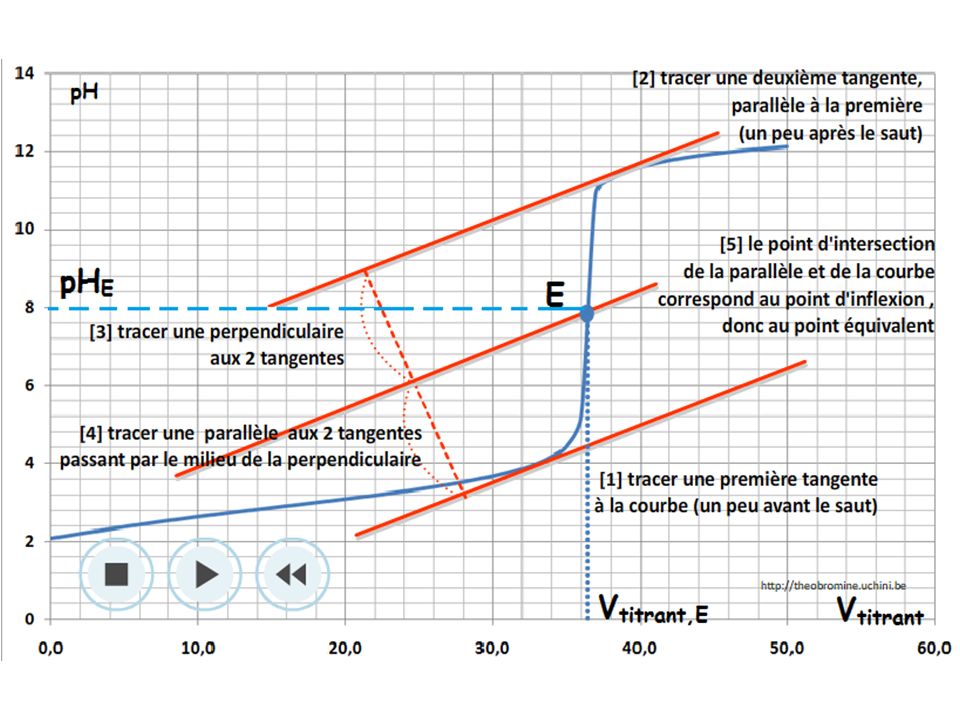
Lors d'un titrage pH-métrique, la brusque variation de pH du graphe pH=f(Vréactif ajouté) permet de repérer l'équivalence du titrage.
L'equivalence du titrage correspond à l'extremum de la courbe dérivée
(dpH)/(dVréactif ajouté)=f(Vréactif ajouté)
cas d'un titrage par colorimétrie
Un changement de teinte du mélange réactionnel permet de repérer l'équivalence. Ce repérage peut être facilité par l'utilisation d'un indicateur de fin de réaction
Un indicateur coloré acido-basique est un couple acide/base dont les deux espèces n'ont pas la même teinte. Si sa zone de virage contient le pH à l'équivalence pHe, il peut être utilisé comme indicateur de fin de réaction.
Expression du résultat d'un titrage
La concentration de la solution titrée est déterminée avec un intervalle de confiance tenant compte de l'ensemble des sources d'erreur et s'exprime avec un nombre de chiffres significatifs égal à celui de la donnée la moins précise.
-Incertitudes liées aux manipulations
-Incertitudes liées à la méthode de titrage employée
-Incertitudes liées à la verrerie