La Chimie
Composées ioniques et moléculaire
Les composés ioniques se forment lorsque les atomes transfèrent des électrons pour créer des ions chargés positivement appelés ions chargés négativement.
appelés anions, qui sont maintenus ensemble par de fortes forces électrostatiques. Ces composés sont généralement des métaux combinés avec un ion non métallique ou polyatomique.
MgS - sulfure de magnesium
Les moléculaires proviennent d'atomes partageant des électrons pour former des liaisons covalentes. Les composés moléculaires sont constitués uniquement d’éléments non métalliques. les composés ioniques sont solides à température ambiante avec des points de fusion et d'ébullition élevés, tandis que les composés moléculaires peuvent exister sous forme de gaz, de liquides ou de solides.
HCl- Acide hydrochlorique
Les charges multiples et ions polyatomiques
Les éléments avec plusieurs charges sont simplement des éléments qui ont deux charges possibles différentes. Si l’élément est en combinaison avec un autre, il aura la charge qui a le plus de sens avec son partenaire atomique. Par exemple le manganèse est un élément qui a soit une charge de -2, soit -4, donc s'il était avec un élément de charge positive 2, sa charge serait de -2.
Les atomes polyatomiques sont des groupes d'atomes liés entre eux par des liaisons covalentes, agissant comme une seule unité dans les réactions chimiques. Un exemple de ceci serait le nitrate, qui est le NO3, qui est une liaison convalente entre l'azote et l'oxygène.
Équilibrer une équation
Équilibrer les équations consiste à s'assurer, lors d'une réaction chimique, que la même quantité d'atomes reste la même des deux côtés de l'équation. Cela signifie que nous suivons la loi de conservation de la masse et que les atomes sont simplement réorganisés et non détruits ou créés.
Subtopic
Les réactions chimique
Les réactions chimiques sont des réactions ent
Types de reactions chimique
Le déplacement simple se produit lorsqu'un élément prend la place d'un autre dans un composé. C'est lorsqu'un élément échangeant sa place, avec un élément plus actif, en repousse un autre moins actif lors d'une réaction chimique.
Synthèse: La synthèse, c'est quand des choses simples s'assemblent pour rendre quelque chose de plus compliqué. Par exemple, lorsque l’hydrogène et l’oxygène se combinent, ils produisent de l’eau.
2H2 + O2 - 2H2O
Déplacement double: Le double déplacement se produit lorsque les ions de deux composés différents changent de place, formant deux nouveaux composés. Par exemple, lorsque vous mélangez du nitrate d’argent avec du chlorure de sodium dans de l’eau, du chlorure d’argent et du nitrate de sodium se forment.
AgNO3 + NaCl - AgCl + NaNO3
Décomposition: La décomposition se produit lorsqu'une substance se décompose en éléments plus simples. Cela peut se produire lorsque des facteurs tels que la chaleur, des réactions chimiques ou une activité biologique affectent l'élément. Par exemple, la matière organique se décompose dans la nature en composés plus simples comme le dioxyde de carbone, l’eau et les minéraux.
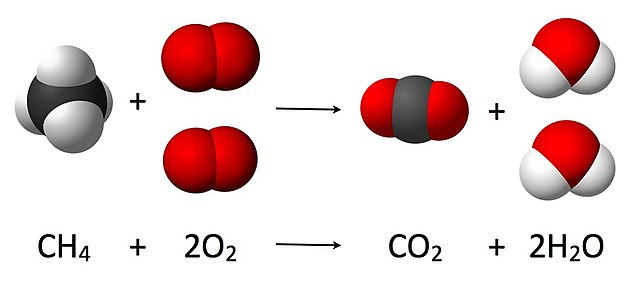
La combustion: La combustion, c'est lorsqu'une substance brûle dans l'oxygène pour produire de la chaleur et de la lumière. Il produit généralement du dioxyde de carbone et de l’eau. C'est que des choses comme les moteurs et les incendies créent de l'énergie.
CH4 + 2 O2 -> CO2 + 2 H2O.
Loi de conservation de la masse
La loi de conservation de la masse stipule qu'au cours d'une réaction chimique, la masse d'une substance avant et après la réaction ne change pas. Elle indique que la matière ne peut être ni créée ni détruite.
t
Tableaux Périodique
Subtopic
Le tableau périodique organise les éléments de manière à montrer leurs similitudes et leurs différences. Chaque ligne, appelée période, vous indique le nombre de couches électroniques que possèdent les atomes d'un élément. Les éléments d’une même colonne, appelés groupes ou familles, partagent des propriétés similaires car ils possèdent le même nombre d’électrons dans leur couche la plus externe, appelés électrons de valence.
Acides et bases
Les acides sont des substances qui libèrent des ions hydrogène lorsqu’ils sont dissous dans l’eau. Ce processus est appelé ionisation. Les acides ont un goût aigre et peuvent réagir avec les métaux pour produire de l'hydrogène gazeux. Des exemples d'acides sont l'acide chlorhydrique et l'acide d'agrumes comme dans les fruits. Les acides ont un pH inférieur à 7, ce qui indique le niveau d'acidité ou la force de la base d'un élément.
Les bases sont des substances qui libèrent des ions hydroxyde lorsqu'elles sont dissoutes dans l'eau. Les bases sont amères et glissantes au toucher. Ils ont un pH de 8 ou plus et sont principalement utilisés dans les produits de nettoyage.