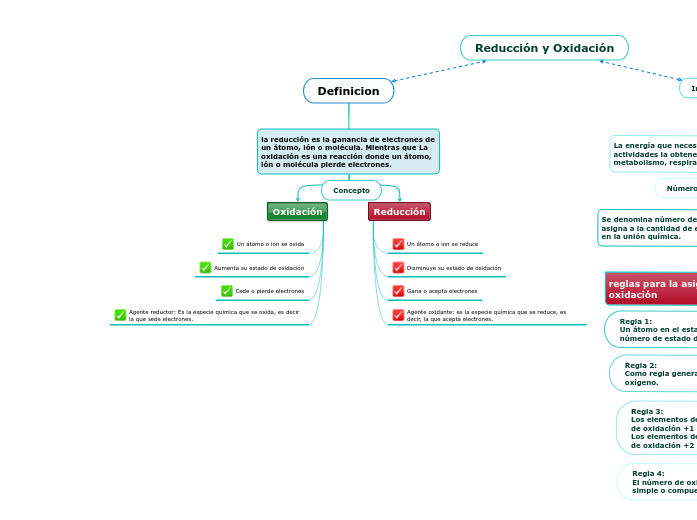
Definicion
la reducción es la ganancia de electrones de un átomo, ión o molécula. Mientras que La oxidación es una reacción donde un átomo, ión o molécula pierde electrones.
Oxidación
Un átomo o ion se oxida
Aumenta su estado de oxidación
Cede o pierde electrones
Agente reductor: Es la especie quimica que se oxida, es decir la que sede electrones.
Reducción
Un átomo o ion se reduce
Disminuye su estado de oxidación
Gana o acepta electrones
Agente oxidante: es la especie química que se reduce, es decir, la que acepta electrones.
Concepto
Importancia
La energía que necesitamos para realizar nuestras
actividades la obtenemos mediante Procesos de metabolismo, respiración celular.
Número de Oxidación
Se denomina número de oxidación a la carga que se le asigna a la cantidad de electrones que cede o recibe en la unión química.
reglas para la asignación de número de oxidación
Regla 1:
Un átomo en el estado elemental tiene número de estado de oxidación cero.
Regla 2:
Como regla general para el hidrógeno y el oxígeno.
Regla 3:
Los elementos del grupo IA tienen estado de oxidación +1
Los elementos del grupo IIA tienen estado de oxidación +2
Regla 4:
El número de oxidación de toda molécula simple o compuesta es cero.
EJERCICIO
En las siguientes reacciones realiza las semirreacciones y señala ¿Quién
se oxida y quien se reduce?, ¿Quién es el agente reductor y el agente
oxidante? Y ¿Cuántos electrones se transfieren en cada una de las
semirreacciones?
NH3 + H2SO4 S+ HNO3 + H2O
SO3 + MnO4- SO4+ Mn+2
Cr2O4=+Fe(OH)2 CrO2 + Fe (OH)3