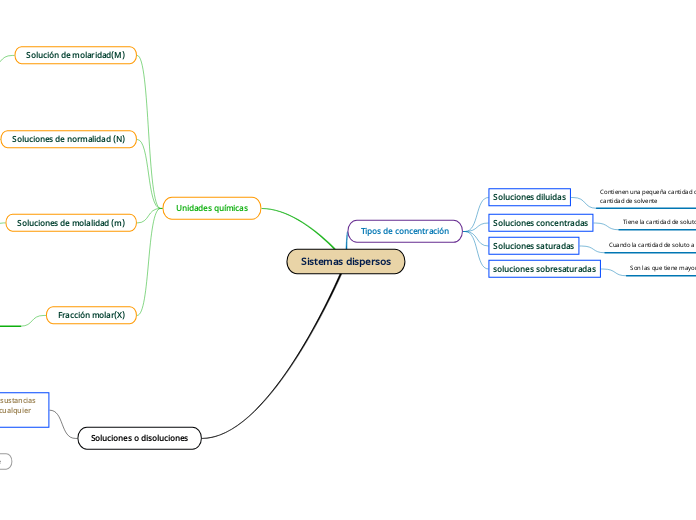
Sistemas dispersos
Tipos de concentración
Soluciones diluidas
Contienen una pequeña cantidad de soluto en una gran cantidad de solvente
Una pizca de sal en el agua
Soluciones concentradas
Tiene la cantidad de soluto un tanto mayor que las diluidas
Café en agua
Soluciones saturadas
Cuando la cantidad de soluto a llegado a su limite
Salmuera
soluciones sobresaturadas
Son las que tiene mayor cantidad de soluto
Miel
Unidades químicas
Solución de molaridad(M)
Es el numero de moles de soluto disuelto o contenidos por cada un litro de solución
Molaridad (M) =
n (nº de moles de soluto)/Volumen de disolución
Calcular la molaridad de una disolución que contiene 2,07·10-2 moles de soluto en 50 ml de disolvente:
molaridad = M = n / V = 2,07·10-2 moles / 0,05 litros = 0,414 molar
Soluciones de normalidad (N)
Se define como el numero de equivalente gramos de soluto disueltos o contenidos por cada un litro de solucion
Normalidad (N) =
nº EQ (equivalentes-gramo)/ Litros de disolución
Calcular la normalidad de 20 gramos de hidróxido de berilio Be(OH)2 en 700 ml de disolución:
Peso molecular del Be(OH)2 = 43
En una disolución el hidróxido de berilio se disocia de la siguiente forma: Be(OH)2 → Be+2 + 2 OH-
Equivalente del Be(OH)2 = peso molecular / nº de OH- = 43 / 2 = 21,5
nº de Equivalentes en 20 g de Be(OH)2 = 20 / 21,5 = 0,93
N = nº de Equivalentes / litros de disolución = 0,93 / 0,7 = 1,33 N
Soluciones de molalidad (m)
Se define como el numero de moles de soluto por cada un kg de disolvente contenido en la solución
Molalidad (m) =
n (nº de moles de soluto)/ Kilogramos de disolvente
Calcular la molaridad de una disolución que contiene 2,07·10-2 moles de soluto en 50 ml de disolvente:
molaridad = M = n / V = 2,07·10-2 moles / 0,05 litros = 0,414 molar
Fracción molar(X)
Es el numero de moles de cada componente(solutos y solventes) por cada un mol de solución
Fracción molar (Xi) =
ni (moles de sustancia)/ nt (moles totales de la disolución)
Calcular la fracción molar de cada una de las sustancias de la disolución de: 10 moles de metanol, 1 mol de etanol y 8 moles de agua.
nt = moles totales de la disolución = nmetanol + netanol + netanol = 10 + 1+ 8 = 19
xmetanol = nmetanol / nt = 10 / 19 = 0,53
xetanol = netanol / nt = 1 / 19 = 0,05
xagua = netanol / nt = 8 / 19 = 0,42
Podemos comprobar que la solución es correcta ya que la suma de las tres es igual a 1:
xmetanol + xetanol + xagua = 0,53 + 0,05 + 0,42 = 1
Soluciones o disoluciones
Son mexclas omogenesa de dos o mas sustancias cuya composicion quimica es igual en cualquier parte de la solucion
Solución: soluto + solvente