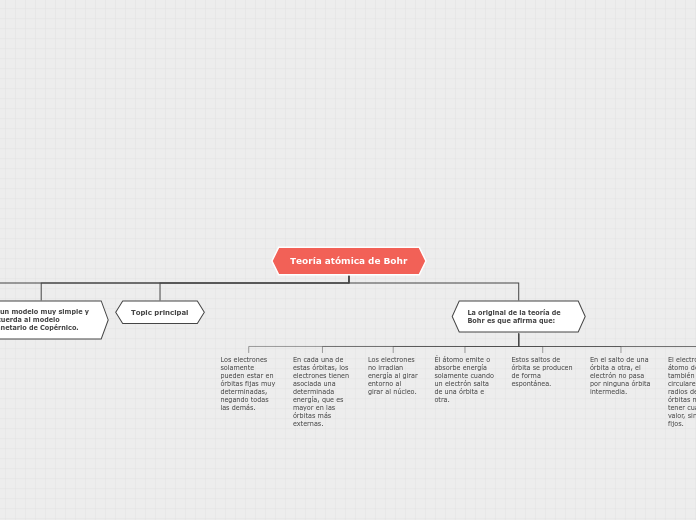
Teoría atómica de Bohr
Toma como referencia los postulados de Plank de 1900 al hablar de quantos o paquetes de energía.
Un quantum o cuanto es la menor cantidad de energía que puede transmitirse en cualquier longitud de onda.
La radiación electromagnética se emite en unidades discretas de energía denominadas quantum o quantos.
Es un modelo muy simple y recuerda al modelo planetario de Copérnico.
Topic principal
La original de la teoría de Bohr es que afirma que:
Los electrones solamente pueden estar en órbitas fijas muy determinadas, negando todas las demás.
En cada una de estas órbitas, los electrones tienen asociada una determinada energía, que es mayor en las órbitas más externas.
Los electrones no irradian energía al girar entorno al girar al núcleo.
Él átomo emite o absorbe energía solamente cuando un electrón salta de una órbita e otra.
Estos saltos de órbita se producen de forma espontánea.
En el salto de una órbita a otra, el electrón no pasa por ninguna órbita intermedia.
El electrón de un átomo describe también órbitas circulares, pero los radios de estas órbitas no pueden tener cualquier valor, sino valores fijos.
Cuando un electrón salta de una órbita a otra, lo hace sin pasar por órbitas intermedias. Esto es una afirmación que rompe las ideas normales que tenemos, porque no podemos visualizar cómo sucede esto exactamente.