da Camilly Vitória mancano 5 anni
352
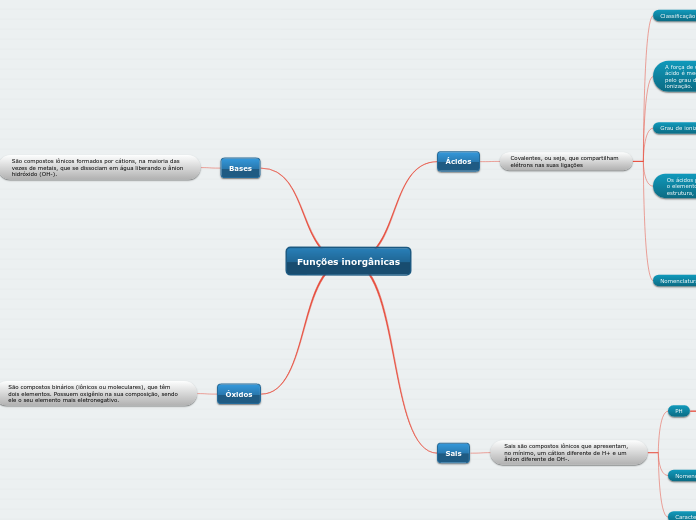
Funções inorgânicas
da Camilly Vitória mancano 5 anni
352

Più simili a questo
Óxido de +nome do elemento combinado com oxigênio
Anfóteros
Podem se comportar como ácidos ou bases.
Peróxidos
Em solução aquosa reagem com a água ou ácidos diluídos e formam água oxigenada.
Neutros
Alguns óxidos que não reagem com a água.
Em solução aquosa reagem com a água e formam ácidos.
Básicos
Em solução aquosa alteram o pH para maior que 7.
Moleculares-Combinação do oxigênio com elementos não metálicos.
Iônicos-Combinação do oxigênio com metais.
Hidróxido de + nome do cátion
Praticamente insolúveis: demais bases.
Pouco solúveis: bases de metais alcalinos terrosos.
Solúveis: bases de metais alcalinos e amônio.
Fracos: possuem grau de dissociação inferior a 5%.
Fortes: possuem grau de dissociação praticamente 100%.
Alfa=número de fórmulas unitárias dissociadas/número de fórmulas unitárias dissociadas no inicio.
Tetrabases: possuem quatro hidroxilas.
Tribases: possuem três hidroxilas.
Dibases: possuem duas hidroxilas.
Monobases: possuem apenas uma hidroxila.
Sofrem ebulição em temperaturas altas.
São sólidos e cristalinos.
São compostos iônicos.
Nome do ânion+de+nome do cátion
Subtópico
Sais básicos-Quando são dissolvidos em água fazem o pH da solução ficar maior que 7.
Sais ácidos-Quando são dissolvidos em água fazem o pH da solução ficar menor que 7.
Sais neutros-Quando são dissolvidos em água não alteram o pH.
oso
Terminação cátion
ico
ídrico
Terminação ânion
ito
ato
eto
Oxiácidos: O elemento oxigênio está presente na estrutura do ácido.
Hidrácidos: não apresentam átomos de oxigênio.
Fracos: possuem grau de ionização inferior a 5%.
Moderados: possuem grau de ionização entre 5% e 50%.
Fortes: possuem grau de ionização superior a 50%.
Alfa=Número de moléculas ionizadas/número de moléculas dissolvidas
Tetrácidos: possuem quatro hidrogênios ionizáveis.
Triácidos: possuem três hidrogênios ionizáveis.
Diácidos: possuem dois hidrogênios ionizáveis.
Monoácidos: possuem apenas um hidrogênio ionizável.