da Leon Gongora mancano 3 anni
230
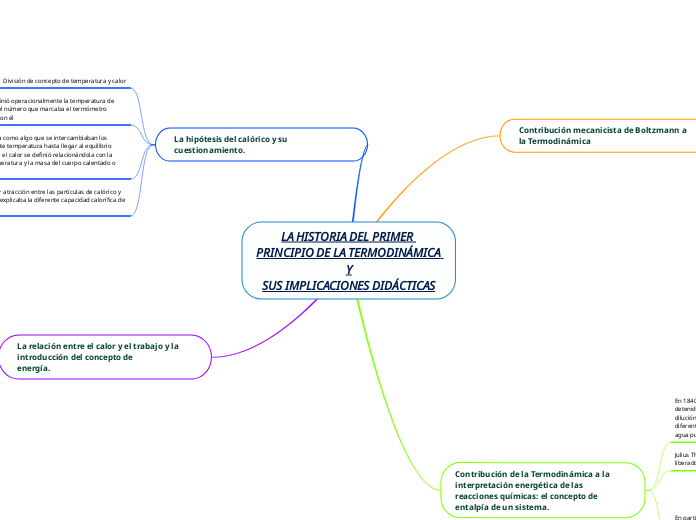
LA HISTORIA DEL PRIMER PRINCIPIO DE LA TERMODINÁMICA Y SUS IMPLICACIONES DIDÁCTICAS
da Leon Gongora mancano 3 anni
230

Più simili a questo