Atomoen arteko loturak
Honen bidez justifikatuta daude
Atomoen konfigurazio elektronikoa
GAS GELDOEN konfigurazioa lortzen dute, e- galtzen, hartzen edo partekatuz. Haien konfigurazioa euki nahi dute egonkortasuna lortzeko.
8 e- dituzte azken mailan.
ZORTZIKOTEAREN ARAUA
Honen bidez gertatzen dira
METALAK ETA EZ- METALAK
Sare kristal ionikoak
LOTURA IONIKOA
EZAUGARRIAK
-Solido gogorrak eta hauskorrak giro tenperaturan. -Uretan disolbagarriak. -Solido egoeran EZ elektrizitatea eroaten, baina uretan edo disolbatuta BAI. -Urtze eta irakite puntu altua. -Egonkortasun handia.
Ionizazio erreakzioaren bidez. (metalak e- galdu, katioiak) (Ez- metalak e- hartu, anioiak) e- transferentzia
Ag+(ac) + Cl-(ac) → AgCl(s)
NaCl

EZ- METALAK ETA EZ- METALAK
LOTURA KOBALENTEA
MOLEKULAK
-Gasak edo likidoak giro tenperaturan, eta urtze puntu baxuko solidoak. -EZ elektrizitatea eroaten. -Uretan disolbaezinak.
-Solidoak, bigunak eta hauskorrak.
-Urtze puntu baxuak.
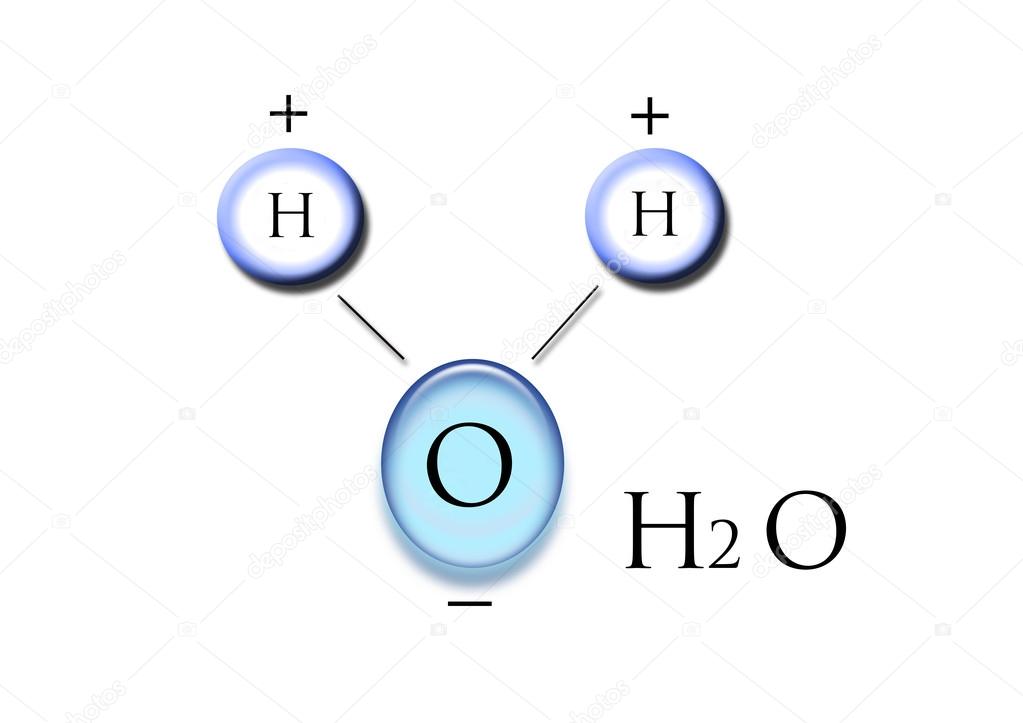
URA

OXIGENOA
Lewis-en adierazpena

Molekulen eta Kristalen adierazpena da
KRISTALAK
-Solido oso gogorrak.
-Egonkortasun handia.
-EZ elektrizitatea eroaten (grafitoa ezik).
-Uretan disolbaezinak.
-Urtze puntu oso altuak.
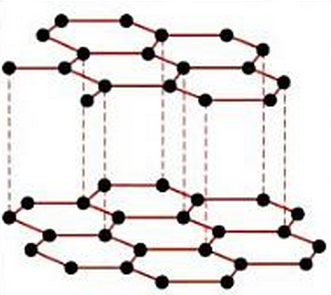
GRAFITOA
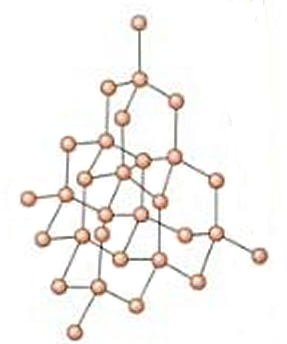
DIAMANTEA
ELEMENTU BEREKO METALEN ATOMOAK
EZAUGARRIAK
-Solidoak giro tenperaturan (Hg ezik).
-Uretan disolbaezinak.
-Bero eta elektrizitate eroale onak.
-Irakite eta urtze puntuak aldakorrak.
-Harikorrak eta xaflakorrak dira.
-Bigunak (marra daitezke), zailak (deformagaitz) eta trinkoak.
-Distiratsuak. EZ gardenak.
LOTURA METALIKOA
Elektroi- hodeiaren eredua
-Metalen atomoak e- partekatu gas geldoen konfigurazioa lortzeko -Balentzia elektroiak galdu eta Elektroi- hodeia eratu nukleo positiboen artean.

Sare kristal metalikoak osatu

Cu