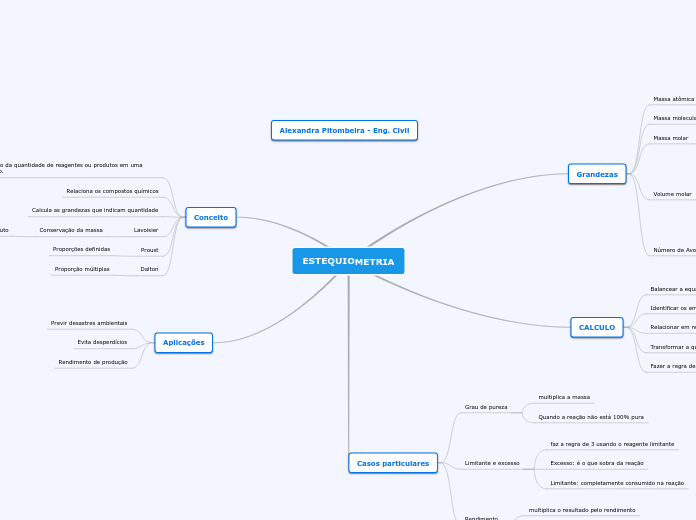
ESTEQUIOMETRIA
Grandezas
Massa atômica
u.m.a (U)
Massa molecular
Soma das massas atômicas
Massa molar
igual à massa atômica grama/mol
Volume molar
CNTP
PV=nRT
R= 0,082
P= 1 atm
T= 0ºC ou 273K
22,4 L/mol
Número de Avogadro: 1 mol = 6,022*10²³
CALCULO
Balancear a equação
Ajustar o coeficientes
Metais / Ametais / H / O
Identificar os envolvidos
Relacionar em número de mols (n)
Transformar a quantidade de número de mols dada
Fazer a regra de 3
Casos particulares
Grau de pureza
multiplica a massa
Quando a reação não está 100% pura
Limitante e excesso
faz a regra de 3 usando o reagente limitante
Excesso: é o que sobra da reação
Limitante: completamente consumido na reação
Rendimento
multiplica o resultado pelo rendimento
Quando uma reação rende abaixo dos 100%
Conceito
relação da quantidade de reagentes ou produtos em uma reação.
Relaciona os compostos químicos
Calcula as grandezas que indicam quantidade
Lavoisier
Conservação da massa
Massa reagente = massa do produto
Proust
Proporções definidas
Dalton
Proporção múltiplas
Aplicações
Previr desastres ambientais
Evita desperdícios
Rendimento de produção