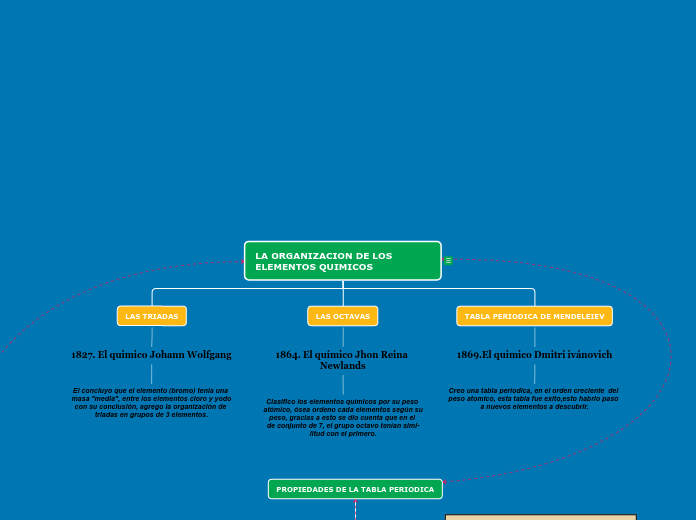
LA ORGANIZACION DE LOS ELEMENTOS QUIMICOS
LAS TRIADAS
1827. El quimico Johann Wolfgang
El concluyo que el elemento (bromo) tenia una
masa "media", entre los elementos cloro y yodo
con su conclusión, agrego la organización de triadas en grupos de 3 elementos.
LAS OCTAVAS
1864. El químico Jhon Reina Newlands
Clasifico los elementos químicos por su peso
atómico, ósea ordeno cada elementos según su
peso, gracias a esto se dio cuenta que en el
de conjunto de 7, el grupo octavo tenían simi-
litud con el primero.
TABLA PERIODICA DE MENDELEIEV
1869.El quimico Dmitri ivánovich
Creo una tabla periodica, en el orden creciente del peso atomico, esta tabla fue exito,esto habrio paso a nuevos elementos a descubrir.
PROPIEDADES DE LA TABLA PERIODICA
LAS PROPIEDADES PERIÓDICAS
Subtopic
RADIO ATÓMICO
Es una forma de medida al tamaño de un atomo.
ELECTRONEGATIVIDAD
La fuerza de un átomo para atraer electrones
para fusionarse a otro átomo.
AFINIDAD ELECTRÓNICA
Es la energía liberada por un átomo neutro
al ganar un electrón, que queda en carga positiva.
ENERGÍA DE IONIZACIÓN
Es la energía para quitarle un electrón a otro átomo el cual es débil mente atraído por su núcleo.
ORGANIZACION DE LA TABLA PERIODICA
GRUPO 1
Estos elementos son los que
tienen un solo electrón, en su ultimo
nivel de valencia. Ejemplo la sal.
GRUPO 2
Los elementos de este grupo
son aquellos que tienen dos
electrones en su ultimo nivel
de valencia. Estos elementos
tienen la "costumbre" de
acceder a fusionarse con otro
átomo fácilmente.
GRUPO 3 AL 12:
Estos elementos so de uso
diario Y/o cotidiano en los
casos laborales. Ejemplo el
uso de los termómetros con
el mercurio.
GRUPO 13
Este grupo hace parte de
la familia de los no metálicos
de los semimetálicos y de los
metálicos. Ejemplo: el aluminio
no se oxida fácilmente, gracias
a esto es de uso cotidiano.
GRUPO 14
Este grupo de elementos hace
parte de la familia del carbono,
el carbono no es metálico, en cambio
el germanio es semimetálicos, el plomo
es metálico. en este grupo hay gran
variedad y diversidad de elementos.
GRUPO 15
Este grupo es familia y se
asocia con el nitrógeno (N)
el elemento mas abundante
en el aire y esencial.
GRUPO 16
Este grupo hace parte
del oxigeno (o), tambien
como oxigeno diatómico (o2)
que se encuentra mas en la
naturaleza, o como el ozono (o3)
que se encuentra en la atmosfera
de nuestro planeta.
GRUPO 17
Este grupo son los elementos
no metálicos, amenudeo tienen
la costumbre de formar iones
negativos, tambien tienden a
capturar electrones.
GRUPO 18
a este grupo le es imposible
formar y/o crear compuestos,
sus compuestos son muy limitados,
normalmente, son gases de baja
densidad como el helio.
TIERRAS RARAS
Este grupo de elementos no son
nada cotidianos, no se encuentran
la naturaleza y son muy unidos, muy
difíciles de separar. Son muy
semejantes entre ellos.