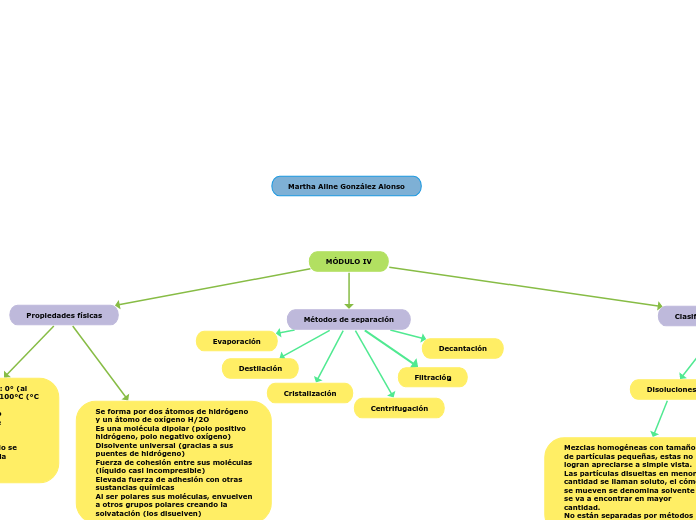
MÓDULO IV
Métodos de separación
Evaporación
Destilación
Cristalización
Decantación
Centrifugación
Propiedades físicas
Inodora, inspiradaPunto de fusión: 0° (al nivel del mar Punto de ebullición: 100°C (°C (al nivel del
mar)Estados de agregación: sólido
(hielo), líquido, gaseoso (vapor de
agua)Densidad: 1 g/cm3Tensión
superficial elevada (pegajosa y
elástica)El agua se expande cuando se
congelaEs la única sustancia líquida
que al solidificarse disminuye su
densidad
Se forma por dos átomos de hidrógeno
y un átomo de oxígeno H/2O
Es una molécula dipolar (polo positivo
hidrógeno, polo negativo oxígeno)
Disolvente universal (gracias a sus
puentes de hidrógeno)
Fuerza de cohesión entre sus moléculas
(líquido casi incompresible)
Elevada fuerza de adhesión con otras
sustancias químicas
Al ser polares sus moléculas, envuelven
a otros grupos polares creando la
solvatación (los disuelven)
Clasificación de las mezclas
Disoluciones
Mezclas homogéneas con tamaño de partículas pequeñas, estas no logran apreciarse a simple vista. Las partículas disueltas en menor cantidad se llaman soluto, el cómo se mueven se denomina solvente y se va a encontrar en mayor cantidad. No están separadas por métodos físicos ni filtración.
Coloides
Mezclas homogéneas compuestas por partículas (de 1 a 1 000 nm), estas se encuentran en las disoluciones. Las partículas están en menor cantidad y se le conoce como "fase dispersa", su movimiento es mínimo y estan en mayor cantidad. Se pueden separar por las fibras porosas y estas si presentan efecto Tyndall.
Suspenciones
Mezclas heterogéneas compuestas por partículas que se pueden ver a simle vista, también encontramos una fase dispersa y dispersora. Presentan efecto Tyndall.