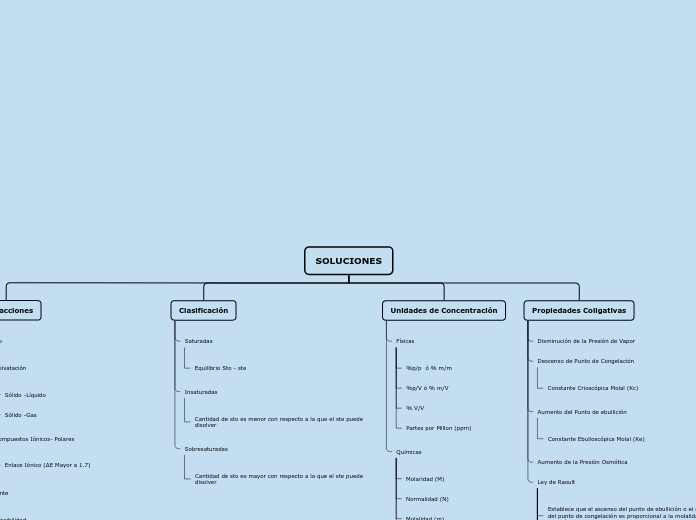
SOLUCIONES
Interacciones
soluto
Solvatación
Sólido -Líquido
Sólido -Gas
Compuestos Iónicos- Polares
Enlace Iónico (ΔE Mayor a 1.7)
solvente
Miscibilidad
Líquido -Líquido
Sólido - Gas
Líquido - Gas
Compuestos Polares o no polares entre sí
Enlace Covalente Polar (ΔE entre 0.5 -1.7)
Enlace Covalente Apolar o No polar (ΔE entre 0 - 0.4)
Solubilidad
Factores
Naturaleza del soluto
Temperatura
Su incremento aumenta la solubilidad de los sólidos
Su disminución aumenta la solubilidad de los gases
Presión
Su incremento aumenta la solubilidad de los gases
No afecta a líquidos y sólidos
Curvas de solubilidad
Clasificación
Saturadas
Equilibrio Sto - ste
Insaturadas
Cantidad de sto es menor con respecto a la que el ste puede disolver
Sobresaturadas
Cantidad de sto es mayor con respecto a la que el ste puede disolver
Unidades de Concentración
Físicas
%p/p ó % m/m
%p/V ó % m/V
% V/V
Partes por Millon (ppm)
Químicas
Molaridad (M)
Normalidad (N)
Molalidad (m)
Fracción Molar (X)
Propiedades Coligativas
Disminución de la Presión de Vapor
Descenso de Punto de Congelación
Constante Crioscópica Molal (Kc)
Aumento del Punto de ebullición
Constante Ebulloscópica Molal (Ke)
Aumento de la Presión Osmótica
Ley de Raoult
Establece que el ascenso del punto de ebullición o el descenso del punto de congelación es proporcional a la molalidad de la solución
Δe = m x Ke
Δc = m x Kc
Subtopic
Δe: Ascenso en el punto de ebullción
m: molalidad
Kc: Constante Crioscópica Molal
Ke: Constante Ebulloscópica Molal
Δc: Descenso en el punto de congelación