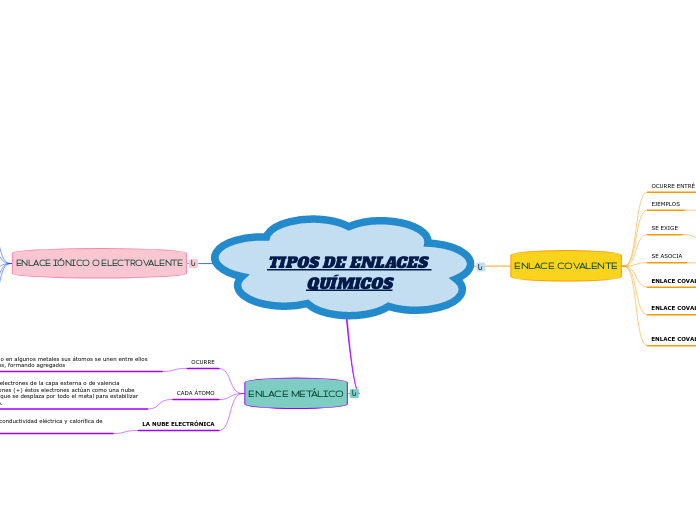
TIPOS DE ENLACES QUÍMICOS
ENLACE COVALENTE
OCURRE ENTRÉ
Los no metales entre ellos mismos o con otros
EJEMPLOS
O2, N2, CO2, Cl2, H2O.
SE EXIGE
Igualdad de condiciones, los átomos unidos poseen una electronegatividad semejante, y por consiguiente los electrones del enlace van a ser compartidos mutuamente.
SE ASOCIA
Como en una cooperativa dónde todos los participantes son favorecidos.
ENLACE COVALENTE NO POLAR
Las electronegatividades son semejantes como por ejemplo oxígeno con oxígeno
ENLACE COVALENTE POLAR
Tendría una polarización al mando, esté tipo de enlace un átomo es parcialmente positivo y otro parcialmente negativo, como por ejemplo el agua, los hidrácidos (HCl, HF, HBR) etc.
ENLACE COVALENTE COORDINADO O DATIVO
Donde uno o unos átomos comparten sus electrones pero hay otro(s) que no aportan, sólo están de cuerpo presente para beneficiarse y también para dar estabilidad a la molécula.
ENLACE IÓNICO O ELECTROVALENTE
ES
La transformación de la sal común
EJEMPLO
El cloro (Cl) elemento negativo con 7 electrones se enlaza al sodio (Na) elemento que al entrar en contacto queda positivo, porque pasa el único electrón de su capa externa y se estabiliza al completar 8 electrones en su último nivel
EXISTE
La transferencia de electrones desde un átomo con menor electronegatividad a uno de mayor electronegatividad.
OTRAS UNIONES
CsF, NaF, KCl, MgCl2, CaCl2, SrCl2, BaCl2, etc
NORMA GENERAL
El "MATRIMONIO IÓNICO" ocurre cuando dos átomos "prometidos" tienen una diferencia de electronegatividad mayor a 2.1 o incluso a 1.7
ENLACE METÁLICO
OCURRE
Cuando en algunos metales sus átomos se unen entre ellos mismos, formando agregados
CADA ÁTOMO
Aporta sus electrones de la capa externa o de valencia formando iones (+) éstos electrones actúan como una nube electrónica que se desplaza por todo el metal para estabilizar el agregado.
LA NUBE ELECTRÓNICA
Permite explicar la alta conductividad eléctrica y calorífica de los metales.