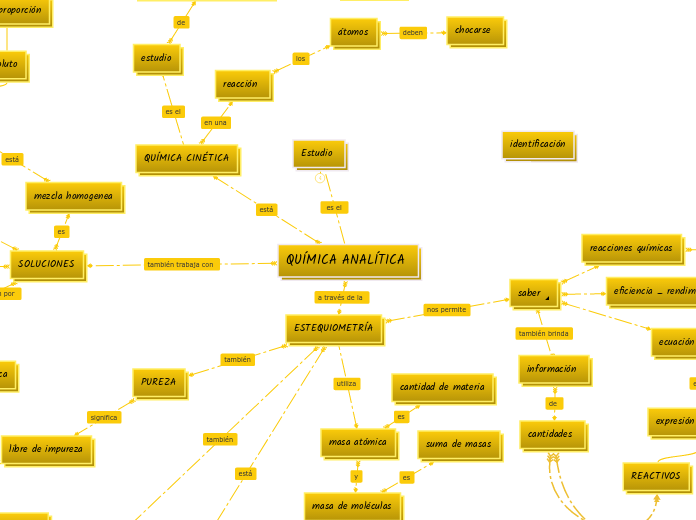
QUÍMICA ANALÍTICA
Estudio
ESTEQUIOMETRÍA
eficiencia _ rendimiento
reacciones químicas
TIPOS
equilobrio
irreversible
reversible
cambio energético
exotérmicas
endotérmicas
combinación o síntesis
descomposición
desplazamiento o sustitución
Doble desplazamiento o sustitución
neutralización
óxido - reducción o redox
oxidación
reducción
ecuación química
expresión simbólica
REACTIVOS
PRODUCTOS
balanceada
información
cantidades
masa atómica
masa de moléculas
suma de masas
cantidad de materia
MOL
unidad de materia
cantidad de partículas
6,02x10 23
volumen en CPT
22,4 L
REACTIVO
limitante
limita
exceso
máxima
PUREZA
libre de impureza
p% mp/mt x 100
QUÍMICA CINÉTICA
estudio
velocidades de las reacciónes
mecanismos
positivas
valor independiente
reactivos
productos
factores
afectan
catalizadores
estado de agregación
grado dedivisión de los reactivos sólidos
temperatura
concentración de las sustancias reacciónantes
proporción de
soluto
solvente
reacción
átomos
chocarse
SOLUCIONES
mezcla homogenea
formado por
solvente
menor proporción
soluto
mayor proporción
proceso solubilidad
físicas o solvatación
quimica
solución = solvente + soluto
concentraciones
FISÍCAS
magnitudes
volumen
litro (l)
mililitro (ml)
masa
gramo (g)
miligramo (mg)
QUÍMICAS
magnitudes
mol
molaridad
equivalente
normalidad
N= n° eq (soluto) / vol (l) solución
TITULACIÓN / VOLUMETRÍA
solución patrón
titulo exacto
valores exatos
concetración
método químico, cuantitativo y volumétrico
ácido
acidimetría
indicador
heliantina
naranja rojizo
base
alcalimetría
indicador
fenolftaleína
violeta
terminar
titular
punto de equivalencia
neutraliza
ácido y base
punto final de la titulación
el indicador
color
volumetría de precipitado
concentración desconocida
solución
método de Mohr
cloruros
bromuros
elementos de laboratorio
soporte universal
matraz con solución
bureta
propipeta y pipeta
Erlenmeyer