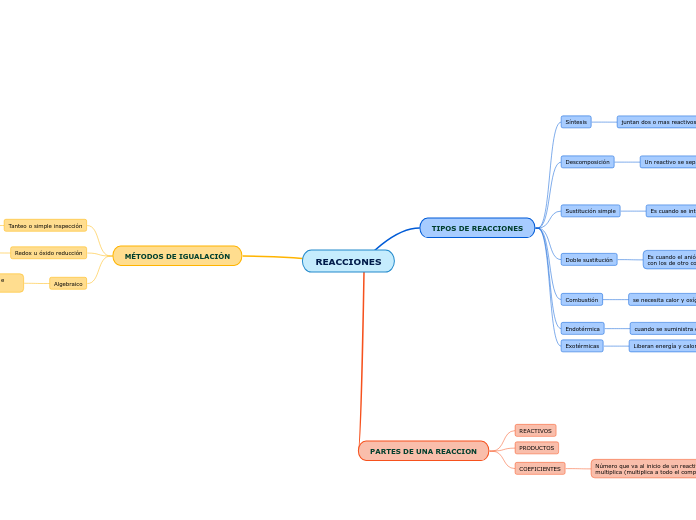
REACCIONES
TIPOS DE REACCIONES
Síntesis
juntan dos o mas reactivos para obtener un producto
A+B=C
SO3+H2O===H2SO4
Descomposición
Un reactivo se separa en dos o mas productos
A=B+C
CaCO3==== CaO+CO2
Sustitución simple
Es cuando se intercambia un catión / anión entre dos reactivos
AB+C=CB+A / AB+C=AC+B
3NaCl+Al===AlCl3+3Na
SO3 + Cl-1==== SCl6 + O2
Doble sustitución
Es cuando el anión y el catión de un compuesto se intercambia con los de otro compuesto
AB+CD=AD+CB
Na(OH)+HClO4===Na(ClO4)+H2O
Combustión
se necesita calor y oxígeno
materia orgánica+O2=CO2+H2O
C6H12O6+O2----- CO2+H2O
Endotérmica
cuando se suministra calor para que se produzca la reacción
Exotérmicas
Liberan energía y calor de manera espontanea
PARTES DE UNA REACCION
REACTIVOS
PRODUCTOS
COEFICIENTES
Número que va al inicio de un reactivo o producto y lo multiplica (multiplica a todo el compuesto)
MÉTODOS DE IGUALACIÓN
Tanteo o simple inspección
Igualar mediante ensayo error
Redox u óxido reducción
Determinar cambios en las valencias de los elementos que se encuentran en reactivos y productos. Estos cambios se dan por la ganancia o perdida de electrones, mismos que se equipara y se obtiene la reacción igualada
Algebraico
Todos los elementos se igualan mediante la formulación e igualación de sistemas de ecuaciones