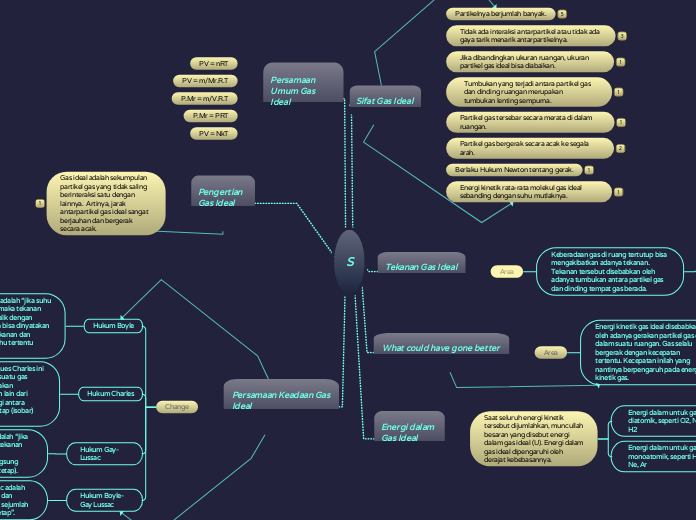
S
Sifat Gas Ideal
Partikelnya berjumlah banyak.
Tidak ada interaksi antarpartikel atau tidak ada gaya tarik menarik antarpartikelnya.
Jika dibandingkan ukuran ruangan, ukuran partikel gas ideal bisa diabaikan.
Tumbukan yang terjadi antara partikel gas dan dinding ruangan merupakan tumbukan lenting sempurna.
Partikel gas tersebar secara merata di dalam ruangan.
Partikel gas bergerak secara acak ke segala arah.
Berlaku Hukum Newton tentang gerak.
Energi kinetik rata-rata molekul gas ideal sebanding dengan suhu mutlaknya.
Tekanan Gas Ideal
Area
Keberadaan gas di ruang tertutup bisa mengakibatkan adanya tekanan. Tekanan tersebut disebabkan oleh adanya tumbukan antara partikel gas dan dinding tempat gas berada.
P = 1/3 N.m.v/V = 2/3 N/V.Ek
What could have gone better
Area
Energi kinetik gas ideal disebabkan oleh adanya gerakan partikel gas di dalam suatu ruangan. Gas selalu bergerak dengan kecepatan tertentu. Kecepatan inilah yang nantinya berpengaruh pada energi kinetik gas.
Ek = 2/3 kT = 3/2 NkT = 3/2 RT
Energi dalam Gas Ideal
Saat seluruh energi kinetik tersebut dijumlahkan, muncullah besaran yang disebut energi dalam gas ideal (U). Energi dalam gas ideal dipengaruhi oleh derajat kebebasannya.
Energi dalam untuk gas diatomik, seperti O2, N2, H2
Energi dalam untuk gas monoatomik, seperti He, Ne, Ar
Persamaan Umum Gas Ideal
PV = nRT
PV = m/Mr.R.T
P.Mr = m/V.R.T
P.Mr = PRT
PV = NkT
Pengertian Gas Ideal
Gas ideal adalah sekumpulan partikel gas yang tidak saling berinteraksi satu dengan lainnya. Artinya, jarak antarpartikel gas ideal sangat berjauhan dan bergerak secara acak.
Persamaan Keadaan Gas Ideal
Change
Hukum Boyle
Pernyataan Hukum Boyle adalah “jika suhu suatu gas dijaga konstan, maka tekanan gas akan berbanding terbalik dengan volumenya”. Istilah lainnya bisa dinyatakan sebagai hasil kali antara tekanan dan volume suatu gas pada suhu tertentu adalah tetap (isotermal).
PV = Konstan
P1V1 = P2V2
Hukum Charles
Hukum yang ditemukan oleh Jacques Charles ini menyatakan bahwa “jika tekanan suatu gas dijaga konstan, maka volume gas akan sebanding suhu mutlaknya”. Istilah lain dari Hukum Charles ini adalah hasil bagi antara volume dan suhu pada tekanan tetap (isobar) akan bernilai tetap
V/T = Konstan
V1/T1 = V2/T2
Hukum Gay-Lussac
Pernyataan Hukum Gay-Lussac adalah “jika volume suatu gas dijaga konstan, tekanan gas akan sebanding dengan suhu mutlaknya”. Artinya, proses berlangsung dalam keadaan isokhorik (volume tetap).
P/T = Konstan
P1/T1 = P2/T2
Hukum Boyle-Gay Lussac
Hukum Boyle- Gay Lussac adalah “hasil kali antara tekanan dan volume dibagi suhu pada sejumlah partikel mol gas adalah tetap”.
PV/T = Konstan
P1V1/T1 = P2V2/T2