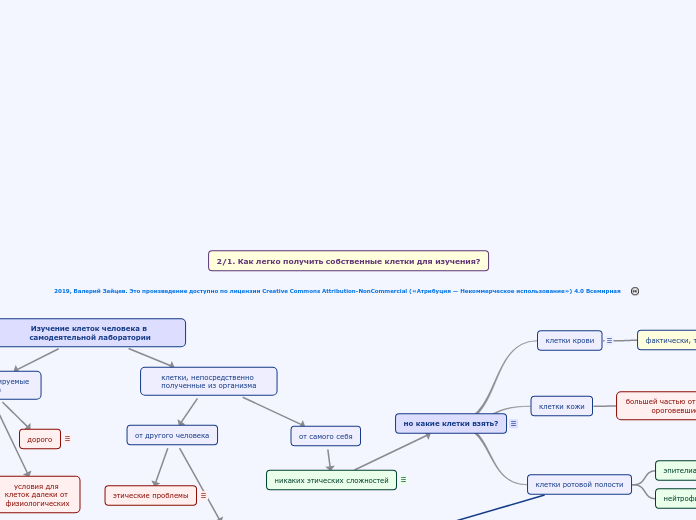
но какие клетки взять?
интенсивное механическое растирание может вызывать разрушение и денатурацию части белков, особенно, крупных
клетки ротовой полости
нейтрофилы
эпителиальные клетки
клетки кожи
большей частью отмирающие или ороговевшие клетки
клетки крови
Самостоятельно относительно безопасным является получение только капиллярной (периферической) крови из пальца - как, например, для анализа глюкозы на домашнем глюкометре
фактически, только эритроциты
Только эритроциты можно получить из капиллярной крови в достаточных количествах для исследований. Содержание остальных клеток в крови значительно ниже, и получить их из 1 мл капиллярной крови (а больше взять весьма непросто) в приемлемых количества очень затруднительно
Статьи для чтения
Rosales, Uribe-Querol, 2017
Carlos Rosales and Eileen Uribe‐Querol (June 7th 2017). Neutrophil Role in Periodontal Disease, Role of Neutrophils in Disease Pathogenesis, Maitham Abbas Khajah, IntechOpen, DOI: 10.5772/67789. Available from: https://www.intechopen.com/books/role-of-neutrophils-in-disease-pathogenesis/neutrophil-role-in-periodontal-disease
Лабораторная работа 2/1
оформление результатов
Выполняется внеаудиторно. Загружается дистанционно для оценки преподавателем с использованием выбранного формата интерактивного общения (LMS, облачное файлохранилище, социальные сети, онлайн-сервисы организации совместной работы и т.д.).
2/1 - описательное
В свободной форме, отражающей:
- цель экспериментов,
- проверяемая научная гипотеза (формулируется самими студентами);
- протоколы выполнения экспериментов;
- пошаговые иллюстрации выполнения протокола в виде фото- или видеофайлов;
- результаты визуализации нейтрофилов и эпителиальных клеток различными видами окраски и их обсуждение;
- общий вывод с указанием, достигнута ли цель эксперимента.
Результаты должны сопровождаться изображениями, полученными в ходе работы и отражающими как этапы выполнения, так и результаты окрашивания клеток.
лабораторные протоколы
2/1. Получение эпителиальных клеток и нейтрофилов ротовой полости
Протокол выполнения опыта
Важно! Необходимо неукоснительное соблюдение техники безопасности работы с биологическими образцами человеческого происхождения. Не допускается работа и контакт с образцами, полученными другими студентами! Весь биологический материал и контактировавшая с ним посуда утилизируются в специальные сосуды.
Ход выполнения
- Прополощите рот 10 мл стерильной воды в течение 2 минут и выплюньте её;
- следующую операцию (№ 3) можно выполнять не ранее чем через 30 мин, в это время не разрешает ни пить, ни есть;
- прополощите рот 10 мл аптечного стерильного физиологического раствора в течение 2 мин, стараясь, чтобы хорошо ополаскивалась передняя часть ротовой полости;
- соберите полоскальную жидкость (далее обозначается ПЖ) в стаканчик;
- отберите 40 мкл ПЖ в микроцентрифужную пробирку на 0,2 или 0,5 мл, добавьте 80 мкл красящей смеси (0,01% раствор генцианового фиолетового в 3% уксусной кислоте);
- через 10 мин подсчитайте количество клеток (эпителиальных и нейтрофилов) в камере Горяева, рассчитайте число клеток каждого из видов в 1 мл ПЖ; устройство камеры Горяева и принципы работы с ней - в отдельном подразделе данной схемы;
- оставшуюся часть ПЖ пропустите последовательно через капроновую сетку с ячейками 500 mesh и 1000 mesh (в пластиковых держателях для фильтров или в воронке);
- фильтрат соберите и отберите по 1,5 мл в две пробирки, затем осадите нейтрофилы центрифугированием при 200 g в течение 15 мин;
- осадок нейтрофилов ресуспендируйте в 100 мкл физиологического раствора в каждой пробирке и объедините;
- фильтр из капроновой сетки 500 mesh промойте в обратном направлении 3 мл физиологического растовора, полученную жидкость разделите по 1,5 мл в две микроцентрифужных пробирки и осадите эпителиальные клетки центрифугированием при 200 g в течение 15 мин;
- осадок эпителиальных клеток ресуспендируйте в 200 мкл физиологического раствора в каждой пробирке и объедините;
- подсчитайте количество нейтрофилов и эпителиальных клеток в полученных препаратах, как в операциях 5-6;
- окрасьте препараты нейтрофилов и эпителиальных клеток прижизненно 0,25% растворами нейтрального красного, конго красного, метиленового голубого и сафранина, добавляя их к суспензии клеток в пропорции 1:10;
- сфотографируйте результаты окрашивания и проанализируйте полученные изображения.
что такое камера Горяева и как ей пользоваться
Хорошее описание есть на сайте «Тесты и задачи по клинической лабораторной диагностике» - пройдите по ссылке
http://cldtest.ru/hdbk/chamber
организация работы
Подготовительная часть (преподаватель + лаборант): подготовка необходимых материалов и оборудования.
Основная часть (студенты на занятии): работа выполняется индивидуально - каждый студент работает с образцами своих собственных клеток.
Важно! Необходимо неукоснительное соблюдение техники безопасности работы с биологическими образцами человеческого происхождения, включая утилизацию биологического материала.
Важно! Поскольку студенты работают с клетками различных субъектов преподавателю следует обеспечить студентам возможность ознакомиться с результатами друг друга. Делать это в ходе выполнения эксперимента или во время заключительного мини-коллоквиума занятия - выбор преподавателя.
результаты обучения
вопросы для обсуждения
- Какие биологические функции выполняют эпителиальные клетки слизистой ротовой полости и нейтрофилы в организме человека?
- Какими способами можно визуализировать клетки человека и животных?
- В чем разница между прижизненным окрашиванием клеток и окрашиванием после фиксации? Какие преимущества и недостатки у каждой из них?
- Какие особенности и свойства клеток можно выявить с использованием витальных и суправитальных красителей?
развиваемые навыки
- выделять клетки из живого организма
- работать с первичными клеточными суспензиями / культурами
- визуализировать клетки различного типа в биологических образцах
Изучение клеток человека в самодеятельной лаборатории
клетки, непосредственно полученные из организма
от самого себя
никаких этических сложностей
Да и заразиться чем-то новым от самого себя невозможно
от другого человека
возможность заражения
Другой человек может болеть чем-нибудь или быть носителем какого-то инфекционного агента
этические проблемы
Существуют строгие правила работы с биологическими материалами от других людей. В частности, такое исследование должно иметь разрешение специального этического комитета. Есть и другие требования. Все они часто не выполнимы легко даже для лабораторий «большой науки»
клетки, культивируемые вне тела
условия для клеток далеки от физиологических
дорого
Культивирование клеточных линий требует дорогостоящего оборудования, включая CO2-инкубатор, ламинарный шкаф для стерильной работы с клетками и значительное число вспомогательных устройств и приспособлений
хорошая воспроизводимость
- Клетки одной клеточной линии однотипны или весьма близки друг к другу
- Легко контролировать условия, в которых находятся клетки
нет этических сложностей
2019, Валерий Зайцев. Это произведение доступно по лицензии Creative Commons Attribution-NonCommercial («Атрибуция — Некоммерческое использование») 4.0 Всемирная
2/1. Как легко получить собственные клетки для изучения?