によって Valery Zaitsev 6年前.
684
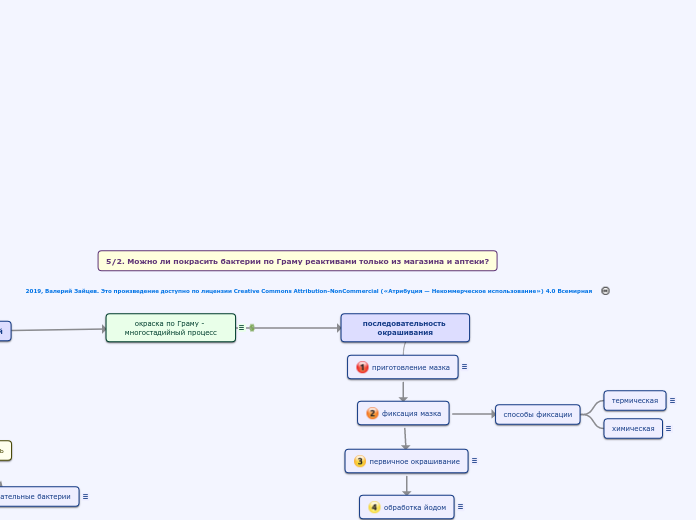
5/2. Можно ли покрасить бактерии по Граму реактивами только из магазина и аптеки?
によって Valery Zaitsev 6年前.
684

もっと見る
Грам-положительные микроорганизмы окрашиваются обычно в темно-синий или фиолетовый цвет (комплекс первичного красителя с йодом), а при использовании бриллиантового зеленого - в ярко-зеленый, окраска грам-отрицательных микроорганизмов зависит от цвета вторичного (дополнительного) красителя: например, розовая или розово-фиолетовая при окрашивании фуксином, красная при окрашивании сафранином, нейтральным красным или конго красным
Использована фотография, выполненная Y tambe, CC-BY-SA
Исследуемый материал (жидкость или суспензия) равномерно распределяют на определенном участке предметного стекла и высушивают. После полного высыхания мазка его фиксируют (стадия 2)
химическая
При химической фиксации высушенный мазок погружают (обычно на 10 мин) в один из органических растворителей:
термическая
наиболее распространенный и более быстрый способ фиксации, по сравнению с химической - для термической фиксации высушенный мазок два-три раза проводится над пламенем горелки или спиртовки
Используемый на этом этапе краситель в отечественной литературе чаще всего называется основны́м, при этом по химической природе он должен быть оснóвным - чтобы избежать двусмысленности из-за игры слов, я использую термин «первичный краситель». Аналогичный термин широко применяется в англоязычной литературе (primary dye)
обработка йодом
Обычно фиксируют раствором Люголя (в микробиологии соотношение йода, йодида калия и воды 1:2:100) - не путайте его с аптечным раствором Люголя (те же компоненты в соотношении 1:2:17). Также может использоваться раствор Грама (соотношение йода, йодида калия и воды 1:2:300)
обесцвечивание первичной окраски
проводят короткой обработкой органическими растворителями - этанолом, метанолом, ацетоном
для улучшения результатов (во избежание переобесцвечивания) можно использовать йодный спирт (0,1% йода и 0,5% йодида калия в этаноле)
вторичное окрашивание
Обычно используются анионные красители
Когда протокол окрашивания клеток содержит несколько этапов формирования окраски, а получающаяся окраска будет минимум двухцветной - такие окраски называют сложными
Silhavy T.J., Kahne D., Walker S. The bacterial cell envelope. Cold Spring Harb. Perspect. Biol. 2010; 2(5): a000414. doi: 10.1101/cshperspect.a000414
Alturkistani H.A., Tashkandi F.M., Mohammedsaleh Z.M. Histological Stains: A Literature Review and Case Study. Glob. J. Health Sci. 2015; 8(3): 72-79. doi: 10.5539/gjhs.v8n3p72
Выполняется внеаудиторно. Загружается дистанционно для оценки преподавателем с использованием выбранного формата интерактивного общения (LMS, облачное файлохранилище, социальные сети, онлайн-сервисы организации совместной работы и т.д.).
В свободной форме, отражающей:
В качестве иллюстративного материала можно использовать фото- или видеофайлы
Протокол выполнения опыта
Приготовление раствора бриллиантового зеленого
Приготовление раствора Люголя для микроскопии
Приготовление йодного спирта
Приготовление раствора вторичного красителя
Обязательные компоненты протокола
Окрашивание по Граму с использованием коммерческого набора реактивов
Окрашивание по Граму с использованием самостоятельно приготовленных реактивов (2 варианта в зависимости от способа обесцвечивания)
Подготовительная часть (преподаватель + лаборант): подготовка необходимых материалов и оборудования.
Подготовительная часть (лаборант): выращивание культур грамположительных (например, Bacillus subtilis, Lactobacillus sp., Streptococcus thermophilus, Lactococcus sp.) и грамотрицательных (например, Escherichia coli) бактерий; приготовление смешанной суспензии грамположительных и грамотрицательных бактерий.
Основная часть (студенты на занятии): работа ведется в парах, полученная у преподавателя суспензия бактерий окрашивается реагенами из коммерческого набора и самостоятельно приготовленными реагентами.
удалить
многие вещества (как высоко-, так и низкомолекулярные) могут либо разрушать ДНК (нуклеазы), либо связывать её, либо мешать её определению (например, РНК и низкомолекулярные нуклеотиды при фотометрическом анализе или ингибиторы амплификации при ПЦР-анализе)