La ecuación de velocidad para una reacción del tipo A + B → C la podemos escribir como:
v = k·[A]n·[B]m
Donde n y m son los órdenes parciales de reacción respecto de A y de B, y k es la constante de velocidad.
Así, por ejemplo, si tomamos como referencia la oxidación de los metales, la oxidación del sodio es muy rápida, la de la plata es muy lenta y la velocidad de la oxidación del hierro es intermedia entre las dos anteriores.
Ejemplo: el carbón arde más rápido cuantos más pequeños son los pedazos; y si está finamente pulverizado, arde tan rápido que provoca una explosión.
Esto explica por qué para evitar la putrefacción de los alimentos los metemos en la nevera o en el congelador. Por el contrario, si queremos cocinarlos,
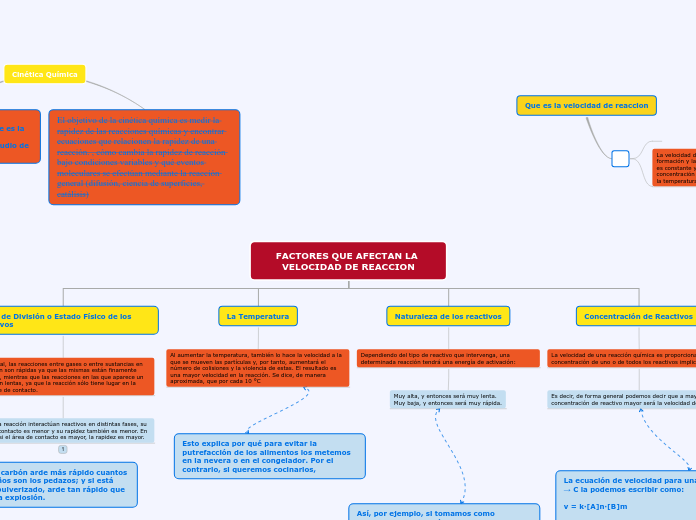
Que es la velocidad de reaccion
La velocidad de reacción está conformada por la velocidad de formación y la velocidad de descomposición. Esta velocidad no es constante y depende de varios factores, como la concentración de los reactivos, la presencia de un catalizador, la temperatura de reacción y el estado físico de los reactivos
Cinética Química
El objetivo de la cinética química es medir la rapidez de las reacciones químicas y encontrar ecuaciones que relacionen la rapidez de una reacción. , cómo cambia la rapidez de reacción bajo condiciones variables y qué eventos moleculares se efectúan mediante la reacción general (difusión, ciencia de superficies, catálisis)
Antes de hablar sobre el tema es importante tener noción sobre lo que es la cinética química; es un área de la fisicoquímica que se encarga del estudio de la rapidez de reacción
FACTORES QUE AFECTAN LA VELOCIDAD DE REACCION
Concentración de Reactivos
La velocidad de una reacción química es proporcional a la concentración de uno o de todos los reactivos implicados.
Es decir, de forma general podemos decir que a mayor concentración de reactivo mayor será la velocidad de reacción.
Naturaleza de los reactivos
Dependiendo del tipo de reactivo que intervenga, una determinada reacción tendrá una energía de activación:
Muy alta, y entonces será muy lenta.
Muy baja, y entonces será muy rápida.
La Temperatura
Al aumentar la temperatura, también lo hace la velocidad a la que se mueven las partículas y, por tanto, aumentará el número de colisiones y la violencia de estas. El resultado es una mayor velocidad en la reacción. Se dice, de manera aproximada, que por cada 10 °C
Grado de División o Estado Físico de los Reactivos
En general, las reacciones entre gases o entre sustancias en disolución son rápidas ya que las mismas están finamente divididas, mientras que las reacciones en las que aparece un sólido son lentas, ya que la reacción sólo tiene lugar en la superficie de contacto.
Si en una reacción interactúan reactivos en distintas fases, su área de contacto es menor y su rapidez también es menor. En cambio, si el área de contacto es mayor, la rapidez es mayor.
Si los reactivos están en estado líquido o sólido, la pulverización, es decir, la reducción a partículas de menor tamaño, aumenta enormemente la velocidad de reacción, ya que facilita el contacto entre los reactivos y, por tanto, la colisión entre las partículas.