Kemijska ravnoteža
La Chatelierovo načelo
- ako se promijeni jedan od uvjeta pri kojima se sustav nalazi u stanju kemijske ravnoteže, pomak reakcije bit će u smjeru one reakcije koja teži da se suprotstavi toj promjeni i da se uspostave prethodni uvjeti
Čimbenici koji utječu na KR
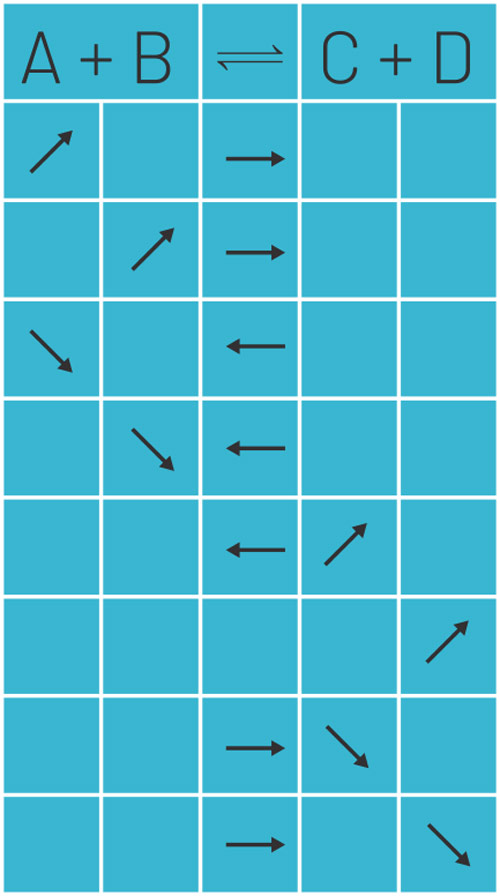
promjena koncentracije
Literary Work
- pri povećanju konc. R ili smanjenju konc. P, ravnoteža se pomiče u smjeru nastajanja P; pri smanjenju konc. R ili povećanju konc. P, ravnoteža se pomiče u smjeru nastajanja R
promjena temperature
- u egzotermnim reakcijama ravnoteža se sniženjem temp. pomiče prema P, a povišenjem temp. prema R
- u endotermnim reakcijama ravnoteža je pri višoj temp. pomaknuta prema P, a pri nižoj temp. prema R
- jedini čimbenik koji mijenja vrijednost konstante kemijske ravnoteže (Kc)
Čimbenici koji utječu na KR
promjena tlaka
- povećanje ukupnog tlaka uzrokuje pomak ravnoteže u smjeru reakcije koja dovodi do smanjenja ukupnog broja molekula (smanjenja tlaka)
- smanjenje tlaka pogoduje smjeru reakcije koja dovodi do povećanja ukupnog broja molekula (povećanja tlaka)
- nema učinka kada je N(R)=N(P)
katalizator?
- ubrzavaju reakcije u jednom i drugom smjeru, ravnoteža se uspostavlja brže, ali ne utječu na pomak ravnoteže
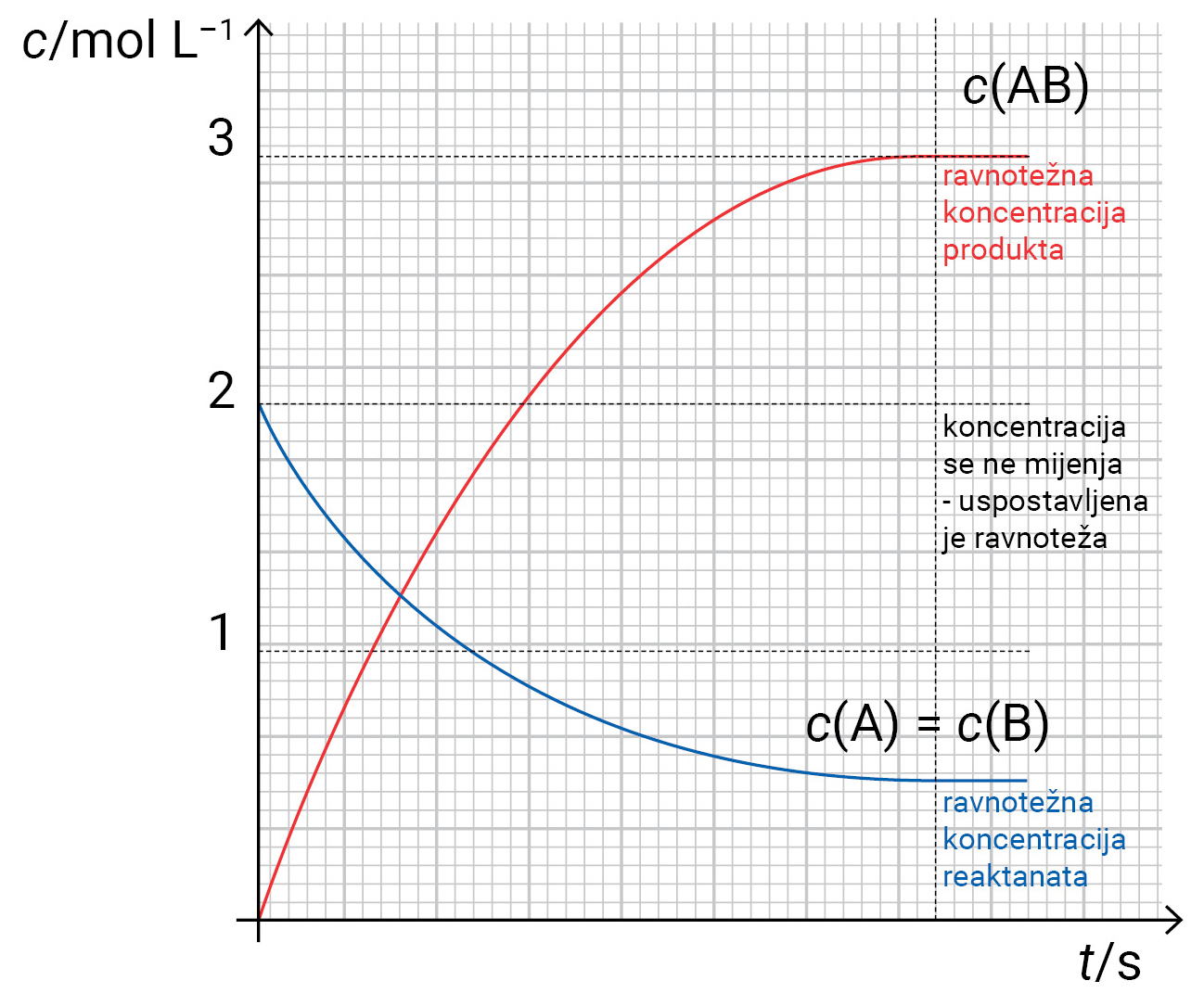
Konstanta kemijske ravnoteže (Kc)
Guldberg-Waageov zakon
Kc je omjer umnožaka ravnotežnih množinskih konc. P i R potenciranih apsolutnim vrijednostima njihovih steh. brojeva pri određenoj temperaturi

ako su vrijednosti Kc u intervalu od 10^-2 do 10^2, prisutni su i R i P
- mijenja se promjenom temperature
- sustav je zatvoren u ravnotežnoj reakciji
tlačna konstanta
- vrijedi za reakciju u kojoj su R i P plinovi, a pritom se rabe vrijednosti parcijalnih tlakova u ravnotežnoj smjesi
Kemijske reakcije - vrsta
ireverzibilne (nepovratne); ⟶
- zagrijavanje bjelanjka, gorenje ugljikovodika, polimerizacija, hrđanje, truljenje
reverzibilne (povratne); ⇄
- fotosinteza, isparavanje/kondenzacija, otapanje soli
- ravnotežne; ⇌
egzotermne
toplina iz sustava izlazi van
endotermne
toplina iz okoline ulazi u sustav
sinteza
analiza
Stupanj iskorištenja reakcije
- omjer mase dobivenog produkta i
maksimalne (teorijske) mase
produkta koju je bilo moguće dobiti
iz zadanih reaktanata
Pokusi
- modra galica: https://www.youtube.com/watch?v=ONNkQkkphHw
- vodikov peroksid + MnO2: https://www.youtube.com/watch?v=yAZRR8eShR8