Железо
Строение атома
Формула

e,N,P

строение атома
физические св-ва

физ. св-ва
железо куется

температура плавления

железо магнитится
Содержание в природе

Fe3O4(магнитный железняк)

подтема

железный или серный колчедан (пирит) FeS2
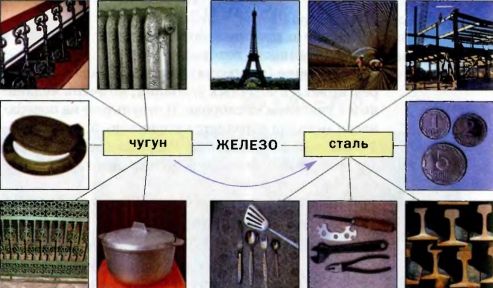
Применение

подтема

подтема
подтема

подтема
подтема
подтема
Положение в переодической таблице

железо в П.С.
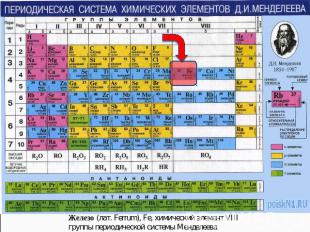
железо в П.С
Химические св-ва
4Fe + 3O2 + 6H2 O → 4Fe(OH)3
Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II, III):
3Fe + 2O2 → Fe3O4
3Fe+2O2→(Fe IIFe2 III)O4 (160 °С)
При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O –t°→ Fe3O4 + 4H2
Железо реагирует с неметаллами при нагревании:
2Fe+3Cl2→2FeCl3 (200 °С)
2Fe + 3Br2 –t°→ 2FeBr3
Fe + S –t°→ FeS (600 °С)
Fe+2S → Fe+2(S2-1) (700°С)

подтема
подтема
подтема
Биологическая Роль

входит в составГемоглабина

подтема
Получение

подтема
из оксида Fe2O3 + 2Al -------> Al2O3 + 2Fe