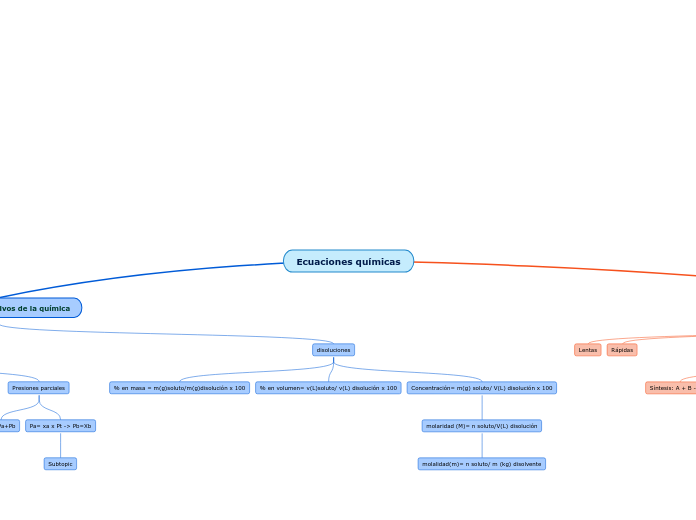
Ecuaciones químicas
aspectos cuantitativos de la química
Masa molar
M= m/M
composición centesimal
%en masa= masa de atomo del elemento/masa molecular del compuesto.
Gases ideales
PxV= n x R x T
P1xV1/T1 = P2xV2/T2
Masa molar+ gases ideales
M= TxmxR/ PxV
T=K -> P1xV1= P2XV2
P=K-> v1/T1= v2/T2
V=K-> P1/T1=P2/T2
Presiones parciales
Pt= Pa+Pb
Pa= xa x Pt -> Pb=Xb
Subtopic
disoluciones
% en masa = m(g)soluto/m(g)disolución x 100
% en volumen= v(L)soluto/ v(L) disolución x 100
Concentración= m(g) soluto/ V(L) disolución x 100
molaridad (M)= n soluto/V(L) disolución
molalidad(m)= n soluto/ m (kg) disolvente
Reacciones químicas
Lentas
Rápidas
Transformación
Síntesis: A + B -> AB
Descomposición-> AB-> A + B
Sustitución
Simple: A + BC-> AB + C
Doble: AB + CD-> AC + BD
Reacción n/volumen
n1/V1=n2/V2
Rendimiento= cantidad real/ cantidad teorica x 100
% Pureza= masa sustancia pura/ masa sustancia impura x 100