Estado sólido de la materia
Cuando los líquidos se enfrían pasan a un estado sólido
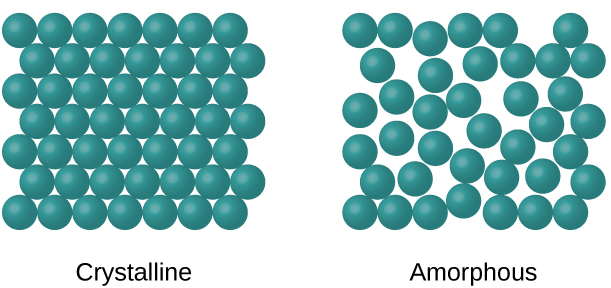
Sus iones, átomos, y moléculas estarán en un patrón repetido definido
Por ejemplo
Los metales y compuestos iónicos
forman
Sólidos cristalinos ordenados
Sustancias de moléculas grandes
con
Movimientos más restringidos
forman
Sólidos amorfos
Sólidos iónicos
Reacción de: elemento metálico + elemento no metálico
ejemplo

Cloruro de sodio
Óxido de niquel
Compuestos de iones positivos y negativos
Que se mantienen unidos por atracciones electrostáticas, bastante fuertes
Cargas mucho mayores que en las cargas parciales en los compuestos moleculares polares
No conducen electricidad
pero
Cuando se funden o disuelven sus iones pueden moverse libremente.
Unión metálica
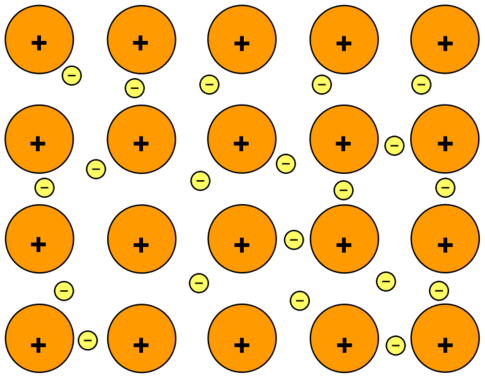
Núcleos atómicos = núcleos positivos + capa interna de electrones y electrones de valencia
Unen casi todos los metales
ejemplo
Cobre
Partículas de átomos electropositivos
Tienen puntos altos de fusión y ebullición
provocan
Fuertes enlaces entre los átomos
Los electrones se mueven libremente en sus orbitales, así que cada electrón se desprende de su átomo principal.
Los electrones están deslocalizados
La fuerza de atracción entre los núcleos positivos y los electrones deslocalizados mantiene unido al metal
características
Brillante, maleable, dúctil
Conductor de calor y electricidad
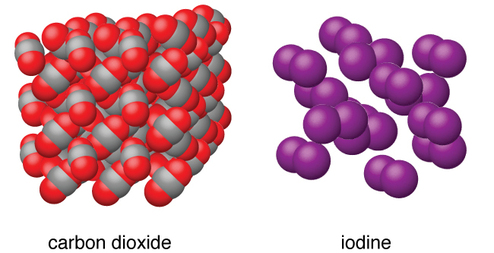
Sólidos moleculares
Están compuestos por moléculas neutras
ejemplo
Hielo
Sacarosa
Yodo
La fuerza de la atracción entre las unidades de cristales varía
Moléculas no polares
Tienen fuerzas de atracción débiles
Puntos de fusiones bajos
Moléculas polares
Compuestos por moléculas con momentos dipolares permanentes
Se funden a temperaturas más altas
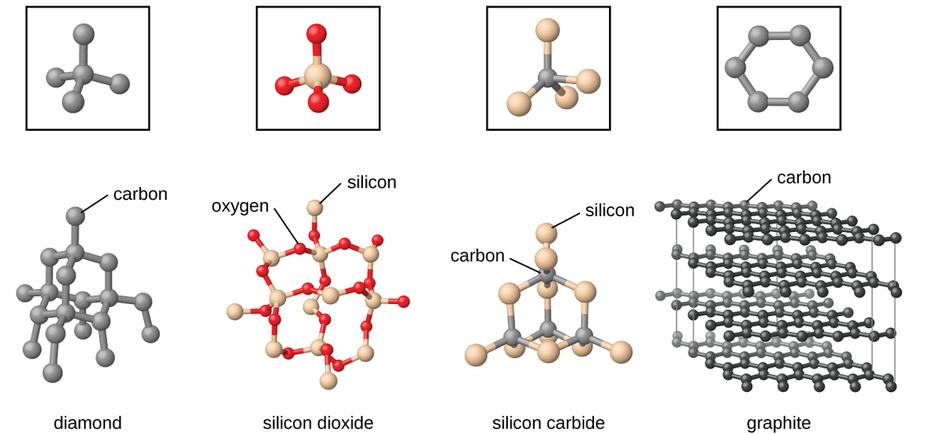
Red covalente
Muchos minerales tienen redes de enlaces covalentes
Los átomos se mantienen unidos por una red de enlaces covalentes
ejemplo
Diamante
Silicio
Para romperla se deben romper los enlaces covalentes
estos tienen
Dureza
Resistencia
Altos puntos de fusión
Arriba de los 3,500° C