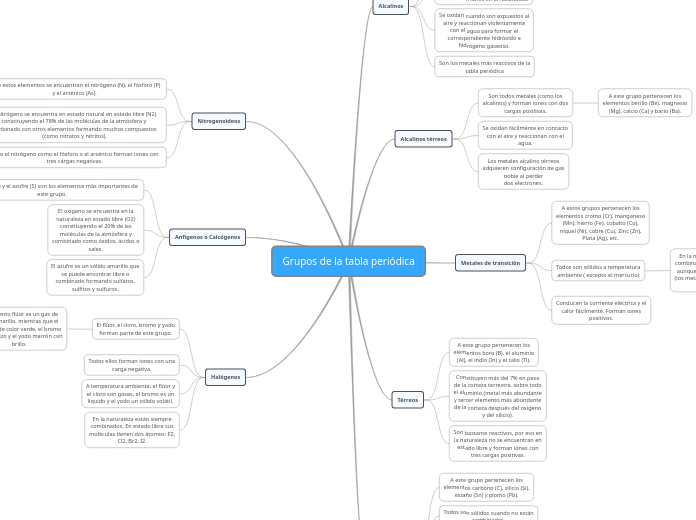
Grupos de la tabla periódica
Alcalinos
Son todos metales sólidos a
temperatura ambiente, blandos y
forman iones con una carga
positiva.
incluye los elementos litio (Li),
sodio (Na), potasio (K), rubidio
(Rb), cesio (Cs) y francio (Fr).
Reaccionan fácilmente con los
otros elementos, por eso no se
encuentran libres en la naturaleza.
Se oxidan cuando son expuestos al
aire y reaccionan violentamente
con el agua para formar el
correspondiente hidróxido e
hidrógeno gaseoso.
Son los metales más reactivos de la
tabla periódica
Alcalinos térreos
Son todos metales (como los
alcalinos) y forman iones con dos
cargas positivas.
A este grupo pertenecen los
elementos berilio (Be), magnesio
(Mg), calcio (Ca) y bario (Ba).
Se oxidan fácilmente en contacto
con el aire y reaccionan con el
agua.
Los metales alcalino térreos
adquieren configuración de gas
noble al perder
dos electrones.
Metales de transición
A estos grupos pertenecen los
elementos cromo (Cr), manganeso
(Mn), hierro (Fe), cobalto (Co),
níquel (Ni), cobre (Cu), Zinc (Zn),
Plata (Ag), etc.
Todos son sólidos a temperatura
ambiente ( excepto el mercurio)
En la naturaleza se encuentran
combinados con otros elementos,
aunque el oro, el cobre y la plata
(los metales acuñables) se pueden
encontrar libres.
Conducen la corriente eléctrica y el
calor fácilmente. Forman iones
positivos.
Térreos
A este grupo pertenecen los
elementos boro (B), el aluminio
(Al), el indio (In) y el talio (Tl).
Constituyen más del 7% en peso
de la corteza terrestre, sobre todo
el aluminio (metal más abundante
y tercer elemento más abundante
de la corteza después del oxígeno
y del silicio).
Son bastante reactivos, por eso en
la naturaleza no se encuentran en
estado libre y forman iones con
tres cargas positivas.
Carbonoideos
A este grupo pertenecen los
elementos carbono (C), silicio (Si),
estaño (Sn) y plomo (Pb).
Todos son sólidos cuando no están
combinados.
El carbono se encuentra libre en la
naturaleza en dos formas: el
diamante y el grafito.
Combinado con otros elementos,
forma los llamados hidrocarburos y
los compuestos característicos de
la vida: azúcares, proteínas,
grasas...
El carbono puede formar
muchísimos compuestos y es la
base de las moléculas relacionadas
con la vida.
Nitrogenoideos
Entre estos elementos se encuentran el nitrógeno (N), el fósforo (P) y el arsénico (As).
El fósforo es un sólido que se presenta principalmente en dos formas alotrópicas: fósforo rojo y fósforo blanco, normalmente se encuentra combinado formado las sales denominadas fosfatos.
El nitrógeno se encuentra en estado natural en estado libre (N2) constituyendo el 78% de las moléculas de la atmósfera y combinado con otros elementos formando muchos compuestos (como nitratos y nitritos).
Tanto el nitrógeno como el fósforo o el arsénico forman iones con tres cargas negativas.
El arsénico fue usado durante mucho tiempo como veneno para controlar plagas.
Anfígenos o Calcógenos
El oxígeno (O) y el azufre (S) son los elementos más importantes de este grupo.
El oxígeno se encuentra en la
naturaleza en estado libre (O2)
constituyendo el 20% de las
moléculas de la atmósfera y
combinado como óxidos, ácidos o
sales.
El azufre es un sólido amarillo que
se puede encontrar libre o
combinado formando sulfatos,
sulfitos y sulfuros.
Halógenos
El flúor, el cloro, bromo y yodo
forman parte de este grupo.
El elemento flúor es un gas de
color amarillo, mientras que el
cloro es de color verde, el bromo
pardo rojizo y el yodo marrón con
brillo.
Todos ellos forman iones con una
carga negativa.
A temperatura ambiente, el flúor y
el cloro son gases, el bromo es un
líquido y el yodo un sólido volátil.
En la naturaleza están siempre
combinados. En estado libre sus
moléculas tienen dos átomos: F2,
Cl2, Br2, I2.