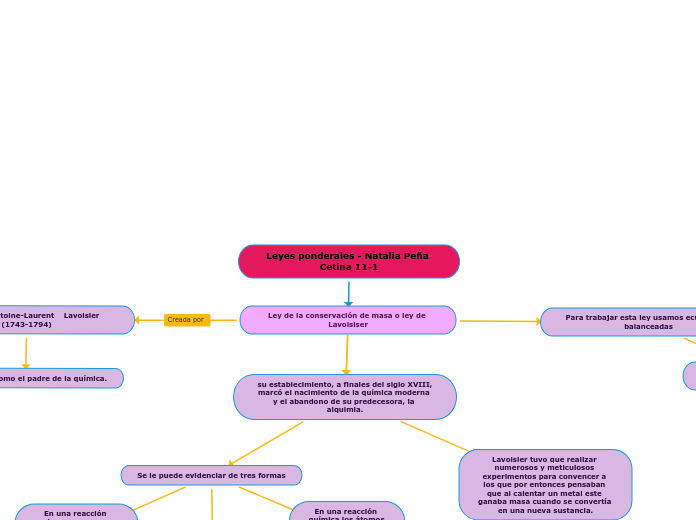
Leyes ponderales - Natalia Peña Cetina 11-1
Ley de la conservación de masa o ley de Lavoisiser
El francés Antoine-Laurent Lavoisier (1743-1794)
se le conoce como el padre de la química.
su establecimiento, a finales del siglo XVIII, marcó el nacimiento de la química moderna y el abandono de su predecesora, la alquimia.
Se le puede evidenciar de tres formas
La materia ni se crea ni se destruye, sólo se transforma.
En una reacción química la suma de la masa de los reactivos es igual a la suma de la masa de los productos.
En una reacción química los átomos no desaparecen, simplemente se ordenan de otra manera.
Lavoisier tuvo que realizar numerosos y meticulosos experimentos para convencer a los que por entonces pensaban que al calentar un metal este ganaba masa cuando se convertía en una nueva sustancia.
Para trabajar esta ley usamos ecuaciones balanceadas
H2 (g) + O2 (g) e H2O (l)
reactivos productos
que se lee "el hidrógeno gas reacciona con el oxígeno gas para daer agua líquida" .
2H2 + O2 => 2H2O
ECUACIÓN QUÍMICA AJUSTADA
que se lee: "2 moléculas de hidrógeno reaccionan con una molécula de oxígeno para dar dos moléculas de agua".