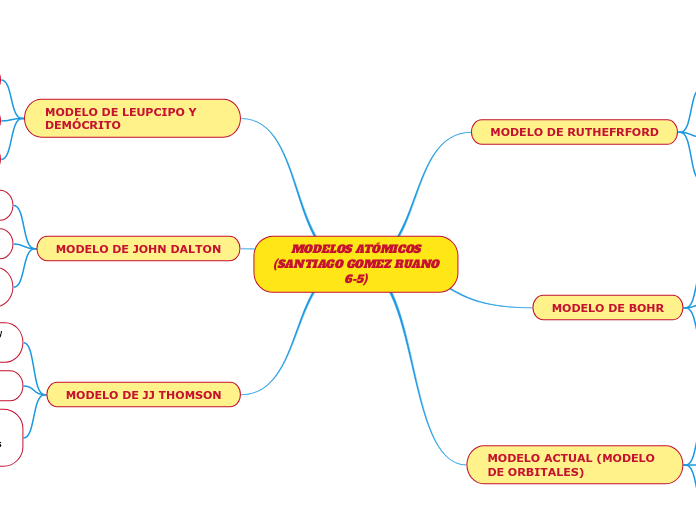
MODELOS ATÓMICOS
(SANTIAGO GOMEZ RUANO
6-5)
MODELO DE RUTHEFRFORD
El átomo tiene un núcleo central en el que están concentrados la carga positiva y prácticamente toda la masa.
IMAGEN
LINK VIDEO - YOUTUBE
La carga positiva de los protones es compensada con la carga negativa de los electrones, que se hayan fuera del núcleo.
El núcleo contiene por tanto, protones en un número igual al de electrones del átomo.
MODELO DE BOHR
El electrón solo se mueve en unas orbitas circulares en las que no emiten energía.
IMAGEN
LINK VIDEO - YOUTUBE
De acuerdo con este nuevo modelo, alrededor del núcleo hay capas o niveles de energía.
La emisión de energía se produce cuando un electrón salta desde un estado inicial de mayor anergia hasta otro de menor energía.
MODELO ACTUAL (MODELO DE ORBITALES)
El electrón se comporta como una onda en su movimiento alrededor del núcleo.
IMAGEN
LINK VIDEO - YOUTUBE
Orbital atómico es la región del espacio, donde existe una probabilidad aceptable de que se encuentre un electrón.
En cada orbital no podrán encontrarse más de dos electrones.
MODELO DE LEUPCIPO Y DEMÓCRITO
Los átomos son eternos, indivisibles, homogéneos e invisibles.
IMAGEN
LINK VIDEO - YOUTUBE
Los átomos se diferencia en su forma y tamaño.
Las propiedades de la materia varían según el agrupamiento de los átomos.
MODELO DE JOHN DALTON
Un átomo es la partícula mas pequeña de un elemento que conserva sus propiedades.
IMAGEN
LINK VIDEO - YOUTUBE
Un elemento es una sustancia pura, que está formada por átomos iguales.
Un compuesto es una sustancia que está formada por átomos distintos combinados en una relación numérica sencilla y constante.
MODELO DE JJ THOMSON
Los electrones tiene carga eléctrica negativa y masa. Cada electrón posee una carga eléctrica elemental.
IMAGEN
LINK VIDEO - YOUTUBE
Los protones tiene carga positiva y mayor masa.
Como el átomo es eléctricamente neutro, hay que suponer que el número de cargas eléctricas negativas (electrones) es igual al número de cargas positivas (protones).