Termoquímica.


Reacción química
Termodinámica
Primer Principio de la termodinamica
Incremento de la energía interna en un sistema es igual a la suma de los calores que recibe mas el trabajo que realiza

Segundo Principio de la termodinámica

La cantidad de entropía del universo tiende a incrementarse en el tiempo.
Estudia el calor y las reacciones
TIPOS
Endotérmica
Es una reacción donde absorbe energía entonces ocurre del medio al sistema
Exotermico

Liberan energía lo que significa que es del sistema al medio.
Elementos de la reacción
CALOR
Energía que se presenta debido a un aumento de energía
Algunos tipos de calor
Entalpia de Formación
Entalpia de enlace
Entalpia de Reacción
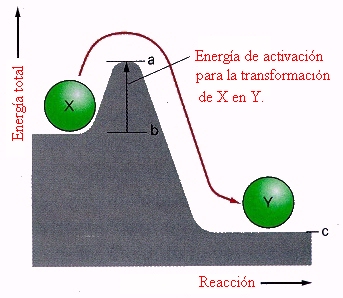
Energía de activación
ES la energía necesaria para que comience una reacción
Velocidad de Reacción
Ley de acción de masas
La velocidad de reacción es directamente proporcional a la concentración de los productos


Es la cantidad de reacción por tiempo
Teoría de las colisiones
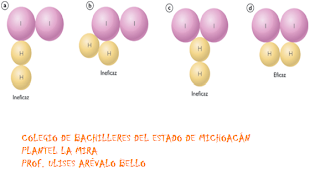
Para que ocurra un cambio las moléculas de las sustancias deben chocar
Los choques tienen que tener una posición para que la distancia y la posición sean viables para los enlaces
Los choques deben tener energía para romperse y formar enlaces químicos
Tipos de choques
Choque ineficaz

Choque eficaz
El choque que provoca la reacción
Los choques que no cumplen estas características son ineficaces
Equilibrio de Reacción
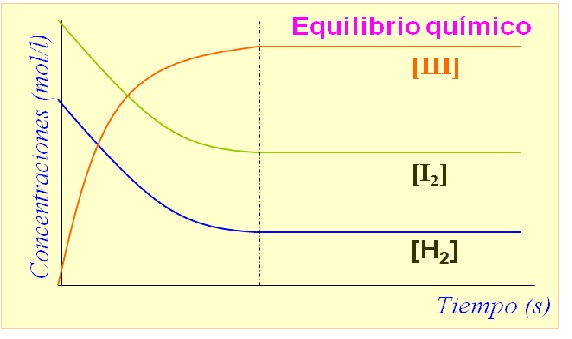
Estado de un sistema que al menos tiene una reacción reversible y la concentración de las cosas no cambie con el tiempo
Principio de le chatelier
Si en un sistema en equilibrio se modifica algún factor como la presión entonces este evolucionara en sentido opuesto a la reacción

Variación que produce un compuesto a partir de sus elementos

Energía para romper un enlace determinado

Diferencia entre entalpía de reactivos y productos

Subtema
Entalpia

Cantidad de energía contenida en una sustancia
Entalpia de Reacción
Entalpia de Enlace
Entalpia de formación
Ley de Hess

Una serie de reactivos reaccionan para dar una serie de productos, el calor de reacción liberado o absorbido es independiente de si la reacción se lleva a cabo en una, dos o más etapas
Entropia

Magnitud termodinámica que indica el grado de desorden molecular de un sistema.
SISTEMAS
Abierto
Aquél que intercambia energía y materia con los alrededores.

Cerrado
Es aquél que intercambia energía (calor y trabajo) pero no materia con los alrededores (su masa permanece constante).