by ANDREA CAROLINA MIRANDA LOPEZ 5 years ago
323
Organigrama
by ANDREA CAROLINA MIRANDA LOPEZ 5 years ago
323

More like this
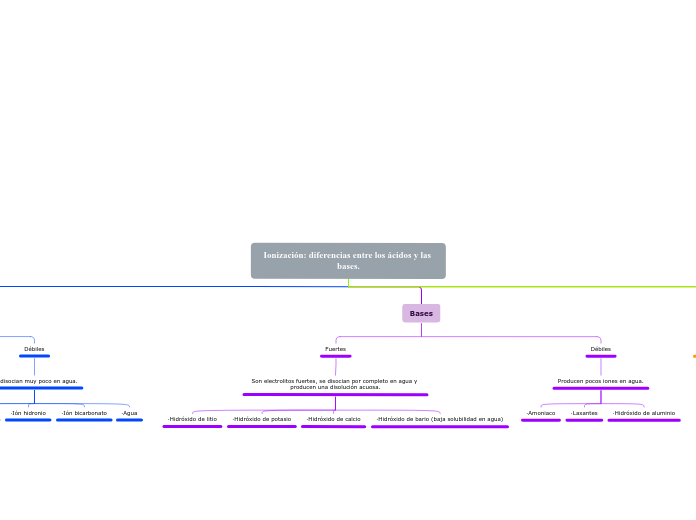
·Hidróxido de aluminio
·Laxantes
·Amoniaco
·Hidróxido de bario (baja solubilidad en agua)
·Hidróxido de calcio
·Hidróxido de potasio
·Hidróxido de litio
·Agua
·Ión bicarbonato
·Ión hidronio
·Acético
·Fosfórico
·Nítrico (menos fuerte)
·Sulfúrico
·Bromhídrico
·Yodhídrico (mas fuerte)