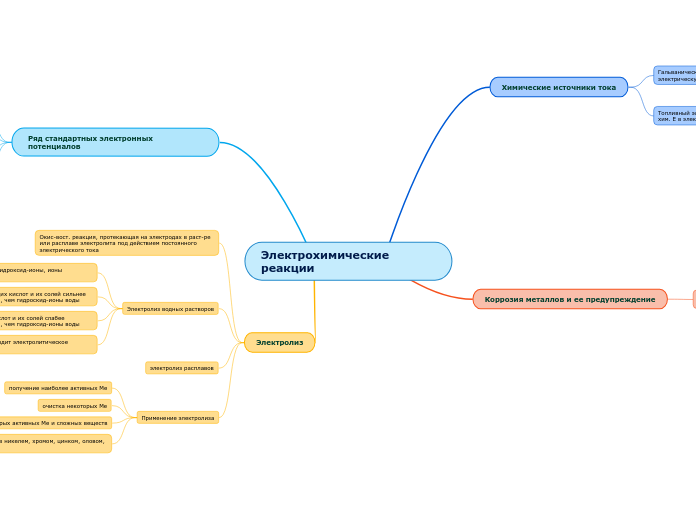
Электрохимические реакции
Химические источники тока
Гальванический элемент(ок.-вос. Е превращается в электрическую Е)
Анод(окис)
Катод(вост.)
Аккумуляторы(постоян. источ. тока)
Топливный элемент(обеспечивает прямое преобразование хим. Е в электрич. Е)
Коррозия металлов и ее предупреждение
Коррозия - разрушение Ме и их сплавов в рез-те воз-я на них окр. среды
Химическая коррозия
Без возникновения электрического тока в системе
Подвергаются Ме, находящиеся в среде газа окисл. или в жидких неэлектролитах
Электрохимическая коррозия
Образуется гальванический эл-нт
С возникновением электрического тока в системе
Атом железа под воздействием кислорода, воды и ионов постепенно окисляются
Методы борьбы с коррозией
Производство Ме, стойких к коррозии
Изменение состава среды
Добавление ингибиторов коррозии
Осушение конструкций
Электрохимические методы защиты
заклепки
пластинки из более активного Ме
Нейтрализация тока
Защитные покрытия
Лаки, краски, эмали, другие Ме
Ряд стандартных электронных потенциалов
Стандартный водородный электрод(электрод сравнения)
Стандартный потенциал водородного электрода = 0
K, Ca, Na, Al, Zn, Fe, Co, Ni, Pb, H2, Cu, Hg, Ag, Au
Сравнение идет только при стандартных условиях
Электролиз
Окис-вост. реакция, протекающая на электродах в раст-ре или расплаве электролита под действием постоянного электрического тока
Электролиз водных растворов
Участвуют ионы водорода, гидроксид-ионы, ионы электролита
анионы кислородосодержащих кислот и их солей сильнее удерживают свои электроны, чем гидроскид-ионы воды
Анионы бескислородных кислот и их солей слабее удерживают свои электроны, чем гидроксид-ионы воды
На катоде и на аоде происходит электролитическое разложение воды
электролиз расплавов
Применение электролиза
получение наиболее активных Ме
очистка некоторых Ме
получение некоторых активных Ме и сложных веществ
Покрытие Ме предметов никелем, хромом, цинком, оловом, золотом и тд.