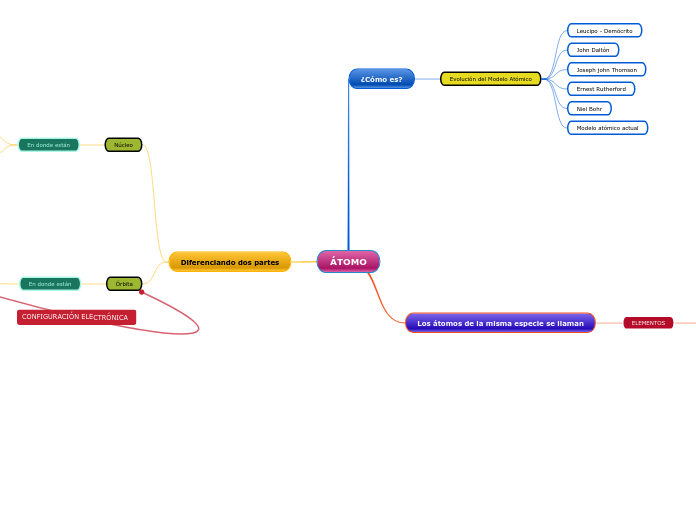
ÁTOMO
¿Cómo es?
Evolución del Modelo Atómico
Leucipo - Demócrito
John Daltón
Joseph john Thomson
Ernest Rutherford
Niel Bohr
Modelo atómico actual
Los átomos de la misma especie se llaman
ELEMENTOS
Clasificados en la
TABLA PERIÓDICA
Organizado por el número ÁTOMICO
"Z"
PROPIEDADES PERIÓDICA
Cómo
ELECTRONEGATIVIDAD
EL RADIO ÁTOMICO
CARÁCTER METALICO
EL RADIO IÓNICO
Se divide en
GRUPOS
Son las columnas verticales
Enumerados del 1 al 18
Los más importantes son
GRUPO 1 : LOS METALES ALCALINOS
Ejemplo: H - Li - Na - K - Rb -Cs -Fr
GRUPO 2: LOS METALES ALCALINOS TÉRREOS
Ejemplo: Be - Mg- Ca- Sr - Ba - Ra
GRUPO 17: LOS HALOGENOS
Ejemplo: F- Cl - Br - I - At
GRUPO 18: LOS GASES NOBLES O INERTES
He - Ne- Ar - Kr - Xe - Rn
PERIODOS
Son las filas Horizontales
Corresponde a los niveles de energía (Número cuántico)
METALES/NO METALES
REGIONES DE ORBITALES
cuatro zonas
Región del Orbital S
Región del Orbital P
Región del Orbital D
Región del Orbital F
Diferenciando dos partes
Núcleo
En donde están
PROTONES
NEUTRONES
Órbita
En donde están
ELECTRONES
Cuatro tipos
1 er # Cuántico
Indica el NIVEL
Del 1 al 7. Corresponde a los periodos de la Tabla Periódica
2do# Cuántico
Indica el SUB NIVEL
Subnivel "S"
Con 2 e-
Subnivel "P"
Con 6 e-
Subnivel "d"
Con 10 e-
Subnivel "f"
Con 14 e-
3ro# Cuántico
Indica el ORBITAL
Nivel + Subnivel
4to# Cuántico
Indica SPIN del electrón
-1/2
+1/2