Enzimas
Generalidades
Definición
Funcional
Catalizadores de la célula. disminuyen la energía de activación.
Estructural
Proteínas. lo mas importante es su conformación tridimensional
Conformación
La mayoría de las enzimas son globulares y por ende solubles. La conformación nativa es la conformación funcional. Es muy importante que una enzima esté bien conformada por el sitio catalítico.
Clasificación
Grupo
1. Oxidorreductasas 2. Transferasas 3. Hidrolasas 4. liasas (sintasa no ATP) 5. Isomerasas 6. Ligasas (sintetasa ATP)
Nomenclatura internacional
4 dígitos
1. Grupo 2. Subgrupo 3. sub subgrupo 4. Identidad
Composición
Simple
Solo proteica
Holoenzimas
Compuestas de una parte proteica (Apoenzima) y una parte no proteica (cofactor)
Cofactores
Metálico
Metaloenzimas
Molécula Orgánica
coenzima
La mayoría viene de vitaminas (micronutrientes esenciales). las coenzimas de vitaminas vienen de las hidrosolubles y la vitamina K
Sitio catalítico
El sustrato y el sitio catalítico son complementarios, por eso las enzimas son catalizadores altamente específicos.
Si la enzima pierde su conformación el sitio catalítico se daña y se desactiva.
Características
- Aumenta velocidad de reacción - Disminuye energía de activación - No se consume - No modifica Ke - Altamente especificas
Isoenzimas
o
Isozimas
Son enzimas que cumplen la misma función en diferentes tejidos.
Se puede diferenciar en el laboratorio clínico.
La ventaja de producir y destruir constantemente enzimas es que nos da una gran adaptabilidad metabólica.
Se dividen en
Enzimas constitutivas
Siempre se destruyen y degradan, siempre están ahí
Enzimas inducibles
Unas veces se sintetizan y otras no
Dependen de los factores inductores como por ejemplo hormonas.
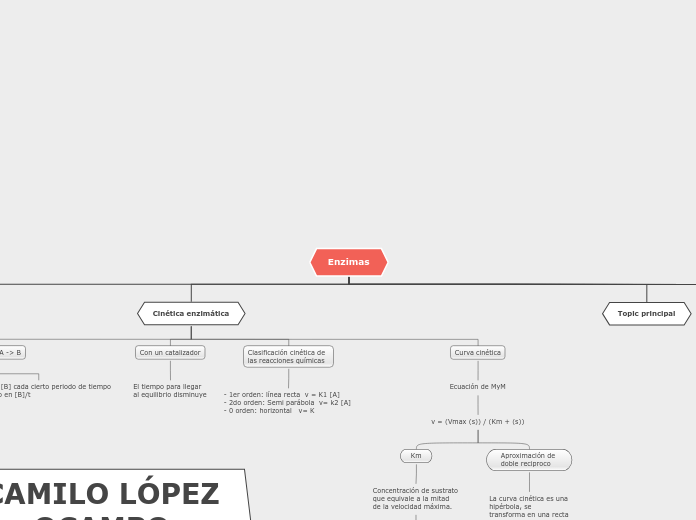
Cinética enzimática
Medir la velocidad de reacción A -> B
Si se tiene [A] cada cierto periodo de tiempo v= -cambio en [A]/t
Si se tiene [B] cada cierto periodo de tiempo v= -cambio en [B]/t
Con un catalizador
El tiempo para llegar al equilibrio disminuye
Clasificación cinética de las reacciones químicas
- 1er orden: línea recta v = K1 [A] - 2do orden: Semi parábola v= k2 [A] - 0 orden: horizontal v= K
Curva cinética
Ecuación de MyM
v = (Vmax (s)) / (Km + (s))
Km
Concentración de sustrato que equivale a la mitad de la velocidad máxima.
Entre mas bajo el Km, mas afinidad tiene el sustrato
Aproximación de doble reciproco
La curva cinética es una hipérbola, se transforma en una recta haciendo una grafica con x=1/s , y=1/v.
intercepto con el eje x= -1/Km
Intercepto con el eje y= 1/Vmax
Topic principal
Temperatura - PH
Actividad enzimática
El comportamiento de una curva en la que el eje x es T y el eje y es v, crece hasta cierta temperatura (temperatura optima de la enzima) y decae rápidamente.
La T° óptima de la mayoría de la enzimas es 44° - 45°, la temperatura de nosotros es mas o meno 35 grados, eso se da para poder tener ese rango de error y no desnaturalizar las proteínas con cualquier cambio
El comportamiento de una curva en la que el eje x es PH y el eje y es v, tiene forma de campana, por lo que se desnaturalizan muy fácil, por eso se tiene amortiguadores en todos los líquidos corporales.
Inhibición enzimática
Reversible
La mayor parte de los fármacos
Competitiva
Análogo estructural del s original
El inhibidor y el sustrato compiten por entrar al sitio activo, con el inhibidor la enzima no funciona
El inhibidor competitivo modifica el Km de la enzima, el Km en presencia del inhibidor se llama Km aparente y es mayor que el Km. Misma velocidad máxima.
No competitiva
No tiene que ser un análogo estructural del s. Afecta un sitio diferente al activo. Hace una conformación que repercute en el sitio activo y se vuelve menos activa la enzima.
El Km no se modifica, pero Disminuye la velocidad máxima que con el inhibidor pasa a llamar velocidad máxima aparente.
Irreversible
La inactiva indefinidamente
Regulación enzimática
Concentración efectiva
Se controla principalmente a nivel transcripcional
Velocidad
Controlar la velocidad enzimática con enzimas reguladoras
En las vías metabólicas casi todas las enzimas NO son regulables, pero debe haber al menos una enzima regulable.
Enzimas alostéricas
La mayoría de las enzimas NO son alostéricas. Cada vía metabólica debe tener al menos una enzima alostérica.
Características
- Tiene nivel 4nario
- Efectores (+), (-)
- Catalizan reacciones irreversibles, ósea alejadas del equilibrio
- Tienen una cinética No michaeliana, se llama sigmoidal. La curva es desplazable con efectores.
- El Km es K0,5
Modulación covalente
No todas las enzimas responden a modulación covalente. Se tiene una enzima que se le pega 1 o varios grupos químicos en determinados sitios. Esa unión cambia la conformación a la enzima y se vuelve mas o menos eficientes.
Se unen muchos grupos, pero el mas común es el grupo fosfato (fosforilar), lo hace una familia de enzimas que se llama protein kinasas que se encargan de fosforilar enzimas con ATP.
Los sitios de fosforilación es los aminoácidos con grupo OH
No dura indefinidamente, se le quita el fosfato con protein fosfatasas.
Las protein kinasas y las protein fosfatasas son activadas por segundos mensajeros.
Activación de zimógenos
Un zimógeno es una proteína inactiva. cuando se activa, se convierte en una enzima activa. Es una enzima con el sitio activo obstruido, el cual se puede liberar de varias maneras
Vitaminas
La mayoría de la coenzimas vienen de vitaminas
Las coenzimas son vitaminas hidrosolubles y la vitamina K
Se divide en
Hidrosolubles
Tiamina (B1)
Se convierte en
Tiamina pirofosfato (TPP)
Se le une covalentemente 2 fosfatos
Participa en reacciones de descarboxilación oxidativa
Se puede convertir en TTP
participa en conducción nerviosa
Deficiencia produce
- Beri Beri
- SIndrome de We
Riboflavina (B2)
Se convierte en
FAD+ (Flavina Adenina Dinucleótido)
Función
Coenzima de oxidorreducción
Transporta 2e y 2H+
FAD -> FADH2
Deficiencia produce
No se produce una enfermedad sino manifestaciones como queilitis y glositis.
Niacina (B3)
Se convierte en
NAD+ (Niacina Adenina Dinucleótido)
NADP+ (Niacina Adenina Dinucleótido)
Función
Coenzimas de oxidorreducción (Transporta H)
Transporta 2e y 2H+
NAD+ -> NADH + H+
Existe la posibilidad de transformar triptófano en NAD pero es poco eficiente, por eso la niacina es esencial.
Deficiencia produce
Pelagra
Acido pantoténico (B5)
Se convierte en
Coenzima A
Función
Transporta radicales acetilo. son importantes para el metabolismo general.
Deficiencia produce
No se describe deficiencia porque está casi en todo.
Piridoxina o piridoxal (B6)
Se convierte en
Piridoxal fosfato
Función
- Importante durante el metabolismo de aas en las transaminasas.
- Importante en la síntesis del grupo HEMO
Deficiencia produce
- Dermatitis crónica
- Alteraciones del SNC
Biotina (B7 / B8)
Se convierte en
Biocitina
Presente en carboxilasas las cuales cogen un sustrato y le incorporan un CO2 en forma de COO-. Importante en el metabolismo de aas, lípidos y carbohidratos
Deficiencia produce
No se ha descrito porque se necesita muy poca y se puede inclusive obtener de bacterias intestinales
Acido fólico (9)
Se convierte en
Acido tetrahidrofólico
Función
Es un transportador de radicales mono carbonados, muchos de estos radicales son importantes para sintetizar bases nitrogenadas, por ende compromete la síntesis de ácidos nucleicos
Deficiencia produce
- Anemia megaloblástica
- Alteraciones congénitas del SNC
Anti fólicos
Se utilizan en protocolos antineoplásicos para bloquear la división celular. Esto se hace inhibiendo la dehidrofolato reductasa.
El mas usado es metotrexate/o
Cobalamina (B12)
- utiliza cobalto
- Solo es sintetizada por algunos organismos del suelo.
- Se necesita muy poca.
- Única vitamina hidrosoluble con deposito
- Se absorbe en un receptor (Cobilina) en el íleon terminal.
- Requiere de varias enzimas para su absorción.
Deficiencia produce
- Anemia perniciosa
- Mala mielinización
Vitamina C (ácido ascórbico)
No es transformada
Funciones
- Síntesis de neurotransmisores
- Antioxidante
- Procesamiento del colágeno, en la síntesis de colágeno participan la prolil y lisil hidroxilasa, ambas necesitan vitamina C.
Deficiencia produce
Escorbuto:
Fácil ruptura de tejidos, equimosis, mala cicatrización, caída de los dientes, etc.
Líposolubles
Vitamina K
formas
Naturales
Ejemplo
- Meno quinona
- Filo quinona
Sintéticas
Ejemplo
Menodiona
Función
Se requiere en el hígado para la síntesis de varios factores de coagulación.
Deficiencia produce
Mala coagulación
CAMILO LÓPEZ OCAMPO MEDICINA UdeA
Comunicación y señalización celular
Capacidad de las células de intercambiar información fisicoquímica con el ambiente y otras células; es un mecanismo homeostático. Hacen parte las células emisoras y las células blanco
Funciones
- Supervivencia
- División
- Diferenciación
- Muerte
Principios generales
- Ligando (primer mensajero)
- Receptor
- Unión específica entre ligando y receptor
Etapas
- Síntesis de mensajero
- Secreción de mensajero
- Trasporte de mensajero
- Detección / recepción
- transducción de la señal
- Eliminación
Formas de comunicación celular
Hay 5 formas
Autocrina
La célula produce el mensajero y señaliza sobre ella misma
Yuxtacrina
Con la célula que está al lado, una célula tiene el ligando y la otra el receptor; Puede haber señalización solo si están unidas
Paracrina
Se produce el mensajero y la vecina tiene el receptor
Endocrina
A través del torrente sanguíneo
Neurotransmisión
A través de un axón se libera mensajes químicos y la célula postsináptica tiene los receptores
Ligandos
Liposolubles
Receptor de membrana o intracelular
Hidrosolubles
Receptor de membrana
Gases
Receptores solubles en el citoplasma
Exposición e internalización de receptores
Regula la disponibilidad de ligandos y receptores por medio de retroalimentación; hace que la célula logre un equilibrio
tipos de retroalimentación
Positiva
Produce mas receptores para aumentar la sensibilidad
Negativa
Internaliza los receptores y disminuye la sensibilidad
Propiedades generales de la unión ligando receptor
- Especificidad
- Saturabilidad
- Reversibilidad
Respuesta tejido-específica
Se puede tener el mismo ligando en varios tejidos y la respuesta puede ser diferente, depende de la maquinaria molecular de cada tipo de célula
Segundos mensajeros
Son intermediarios, moléculas mas pequeñas que se intercalan con muchas proteínas para amplificar la señal de un receptor
Respuestas
Rapida
Con moléculas ya sintetizadas
Lenta
Con regulación de la expresión génica
Encendido molecular
Las activaciones suelen ser estados de fosforilación
Puede ser
Directamente un fosfato
A través de GDP / DTP
Proteínas de andamiaje
La activación del receptor puede llevar a que una proteína cercana a la membrana celular se active, la cual lleva a que otra proteína se active con el animo de que la información se pueda acercar tanto al núcleo como a otro espacio de la membrana celular, son como andamios sin sufrir estados de activación
Cascadas de señalización
Gases
Traspasan la membrana celular y se unen a enzimas o proteínas solubles en el citoplasma, puede producir GMPc
Lípidos
Atraviesan la membrana y se unen a receptores intracelulares que a su vez se translocan al núcleo, el receptor puede ser un factor de transcripción pero también puede activar vías que produzcan segundos mensajeros como Ca2+, AMPc, PI, DAG
Aminas
Se puede unir a
Receptores acoplados a proteínas G
Cascada de señalización
Llega el ligando y se une al receptor, hay un encendido molecular en la que se cambia GDP por GTP sobre la subunidad alfa de la proteína G, luego se disocia de las unidades beta y gamma
Las subunidades beta y gamma pueden abrir canales iónicos y cuando se inactiva la subunidad alfa queda alfa-GDP, se une de nuevo con beta y gamma y queda la proteína efectora inactiva
La subunidad alfa se une con una proteína efectora
Adenil ciclasa (Vía PKA)
Esta proteína es capaz de catalizar una reacción en la que el ATP pasa a AMPc el cual es capaz de activar varias enzimas, el AMPc se une con la PKA que tiene 2 subunidades reguladoras y 2 catalíticas, el AMPc se une a las 2 reguladoras y se liberan las 2 catalíticas que pueden trastocarse al núcleo.
Fosfolipasa C (Vía PKC)
Esta proteína va a convertir el fosfatidil inositol bifosfato en 2 segundos mensajeros: IP3 y DAG.
El PI3 se va al RE que tienen unos receptores canal de PI3 que van a dejar salir Ca2+ del RE, el Ca2+ va y se una junto con DAG a la PKC dejándola totalmente activa.
Ca2+ puede activar otras enzimas como la calmodulina que es capaz de inducir la óxido nítrico sintasa que parte la arginina en óxido nítrico y citrulina.
Canales iónicos
Va a permitir la entrada de iones entre ellos el Ca2+
polipeptídicos
Los factores tróficos o de crecimiento son los que mantienen a la célula viva, si no están activos generan procesos de muerte. Hay varias familias de receptores, la familia mas conocida es la tirosín quinasa, nos vamos a enfocar en esa familia, esos receptores tienen dominios ricos en tirosina, se van a auto fosforilar en esos dominios cuando se une el ligando.
Pueden pasar 2 cosas
Esas fosforilaciones hace que otras proteínas adaptadoras con dominios SH2 y PTB se unan y reconozcan esos sitios sitios, las proteínas adaptadoras son SOS y Grb2.
Las proteínas adaptadoras facilitan la activación de unas proteínas mas pequeñas, mas cerca a la membrana que son proteínas activadoras de Ras que van a activar a Ras (protoncogénica, en condición normal simplemente ayuda a la división celular)
Ras es una proteína G monomérica, en la activación de esta pasa de Ras-GDP a Ras-GTP. Ras-GTP es una proteína que activa si o si la proliferación celular. Ras-GTP activa una serie de enzimas (3) llamadas MAP kinasas: RAF (MAP quinasa quinasa quinasa), MEK (MAP quinasa quinasa) y ERK (MAP quinasa)
Ras-GTP activa a RAF, RAF activa a MEK y MEK activa a ERK
MAP-quinasa (ERK) es capaz de activar a otras proteínas implicadas en la división, proliferación y supervivencia celular que pueden hacer las veces de factor de transcripción.
Esta vía es mas que todo de proliferación
Entrar en la vía PI3K (fosfatidil inositol 3 quinasa)
PI3K va a fosforilar un fosfatidilinositol bifosfato (PIP2) para convertirlo en un fosfatidilinositol trifosfato (PIP3)
pueden pasar 2 cosas
BTK con su dominio plextrina va a reconocer a PIP3, luego se activa la fosfolipasa C (PLC), la cual coge un PIP2 y lo parte en IP3 y DAG, el IP3 saca Ca2+ del RE, ese Ca2+ junto con el DAG van a activar PKC
PIP3 va a atraer a PDK, la cual va a activar a PKB (o AKT), cuando PKB está activa es capaz de inducir genes prosupervivencia. Así como hay genes pro-supervivencia en la familia de Bcl2, hay miembros pro-muerte, los mas conocidos son Bad, Bclxs, Bim, Bid. Los miembros de la familia Bcl2 están en la mitocondria.
PKB activa es capaz de fosforilar a los promuerte y los bloquea (Bloqueo de muerte). Cuando no se activa PKB no se puede fosforilar a Bad y este forma un poro mitocondrial transitorio, proteínas mitocondriales como citocromo C y smat/diablo, las cuales van a activar a Apaf y caspasa 9 la cual es capaz de activar a las caspasas efectoras 3, 6, 7 que son capaces de inducir a la muerte celular activando nucleasas, proteasas, lipasas, etc.
Muerte celular (Apoptosis)
Es una función celular, es un mecanismo de control de la población celular (es dependiente de ATP)
Situaciones que ayudan a activar muerte celular
- Falta de nucleótidos
- Radiación UV
- Radiación ionizante
- Señales oncogénicas
- Hipoxia
- Bloqueo en transcripción
Diferencia con necrosis
La apoptosis no es pro-inflamatoria, es dependiente de ATP y puede llegar a ser reversible mientras que la necrosis es pro-inflamatoria, no depende de ATP y es irreversible; Además la necrosis es un daño masivo, se degrada el núcleo, se degradan organelas, se estalla la célula; cuando una célula recibe un daño, se hinchan las organelas, las células se estallan y hay una invasión de fagocíticos, mientras que en la apoptosis se puede afectar solo una célula, se desprende de las vecinas, no se hincha sino que se encoge, luego es fagocitada pero sus células vecinas y el tejido en general no se ven afectados.
La necrosis se da por permeabilidad de la membrana mitocondrial, perdida del potencial de la membrana mitocondrial e incapacidad de producción de ATP; en la apoptosis no hay perdida de la integridad de la membrana mitocondrial, pero si hay formación de poro transitorio
tipos de necrosis
- Coagulativa (Isquemia)
- Licuefactiva (escape de hidrolasas)
- Grasa (escapa de lipasas)
- Necrosis caseosa (e.g., licuefacción bacteriana)
- Gangrenosa (Necrosis coagulativa)
Importancia de la regulación de la muerte
- Es muy importante porque ayuda a controlar la proliferación, diferenciación y envejecimiento.
- Si una célula está dañada de manera irreparable, debe morir por apoptosis.
- Cuando no se eliminan las células que se están proliferando de manera indiscriminada puede generar neoplasia.
- Cuando se tiene una progresión de muerte celular ósea muerte neurodegenerativa (puede durar hasta 20 años)
Fases de la apoptosis
Decisión
Cuando ocurren los daños
Compromiso
Ya está el daño, se compromete la mitocondria, sale el citocromo C y demás moléculas; se activa la caspasa 9 (Si se interviene se puede revertir)
Ejecución de muerte
Ya están activas las caspasas ejecutoras (Hay cambios importantes) y ya no puede ser reversible
Cascada de señalización de la muerte
Hay 2 tipos de vías de muerte apoptótica
Intrínseca
Es una situación de desbalance interno que afecta los genes de la familia Bcl2, afecta los prosupervivencia y promueve los pro-muerte. Puede llevar a que no se active la vía PI3K y dar vía libre a no bloquear a Bax o Bad
Se da por
Deprivación de oxígeno, radiación ionizante, radiación ultravioleta , etc.
Extrínseca
Dependiente de un ligando de muerte que se une al receptor de muerte, este activa caspasas como la 8 que van a activar las caspasas ejecutoras
CAMILO LÓPEZ OCAMPO MEDICINA UdeA
CAMILO LÓPEZ OCAMPO MEDICINA UdeA
CAMILO LÓPEZ OCAMPO MEDICINA UdeA
CICLO CELULAR
Es un proceso donde se comienza y termina en un mismo punto, además se repite; en este caso para aumentar el número de células de un organismo.
Conceptos relevantes
Ciclo
Algo que comienza y termina en el mismo punto y se repite
Células somáticas
Conforman la parte estructural de los órganos
Células germinales
Precursoras de las células sexuales (espermatozoides y ovocitos)
Gametos
Células sexuales (contienen la mitad del material genético 23 (n))
Haploide
23 (n) cromosomas, tiene solo la mitad del material genético.
Diploide
46 (2n) cromosomas
Diada
Cromosomas duplicados
Tétrada
2 cromosomas duplicados emparejados, solo se ve en meiosis.
Euploidía
Número correcto de cromosomas
Aneuploidía
Variación en el número o estructura cromosómica
Locus
Los genes tienen ubicaciones específicas en los cromosomas.
Se divide en
División celular (M)
Mitosis
Es un proceso por el que a partir de una célula se obtienen 2 células con la misma cantidad y calidad de material genético entre sí y con respecto a la célula original. Se tiene una célula que pasa por interfase y duplica su material genético, en G2 tiene 23 pares de cromosomas suplicados 46x2 (2nx2), cuando se divide cada una de las células hijas queda con 46 (2n) cromosomas e iguales.
Meiosis
En células germinales, se tiene una célula con 46 cromosomas, pasa por interfase y duplica su material, luego hace 2 divisiones consecutivas sin volver a pasar por interfase, hace meiosis 1 y meiosis 2, cuando está en G2 tiene 46x2 (2nx2) cromosomas, la célula entra en la primera división y pasa de 46x2 (2nx2) cromosomas a 23x2 (nx2) cromosomas, ósea que en la primera división no hay división centromérica sino que los cromosomas homólogos migran a polos opuestos, en la segunda división hay 23 cromosomas duplicados 23x2 (nx2), ahora si hay división del centrómero, la anafase reparte las cromátidas para una lado y pal otro, quedan 23 cromosomas sencillos en cada uno 23 (n), en un gameto maduro siempre se tiene 23 cromosomas porque se van a unir con los 23 de la contraparte y van a restablecer el número de 46 cromosomas típico. La primera división se llama meiosis I o división reduccional, la segunda meiosis se llama meiosis II o división ecuacional.
Interfase
Todo ciclo celular inicia en interfase, es un periodo necesario para duplicar el material genético y preparar la célula para la división, en interfase no se ven cromosomas.
se divide en
G1
La célula aumenta de tamaño; hay síntesis de microtúbulos, microfilamentos, ribosomas y se renueva el RE.
S
Se duplica el material genético, hay sintesis de ADN, histonas y otras proteínas.
G2
Paso antes de la división, se hace una preparación para la división, se hace una repartición justa y hay mucha producción de ATP.
Material genético
Se observa como cromosomas en la división celular, se observa como cromatina en el periodo de interfase, la cromatina está compuesta por histonas y ADN.
Niveles de complejidad
Doble hélice
Molécula de ADN
Nucleosoma
ADN + Histonas
Solenoide
Enrollamiento de nucleosomas
Cromátida
Un lado de los cromosomas
Cromosomas
Se tiene 2 cromátidas hermanas unidas por cohesina, a medida que pasa la división el cromosoma se va condensando hasta llegar a metafase que es donde presenta el grado máximo de condensación, el centrómero tiene como agarraderas que se llaman cinetocoro, en el cinetocoro el aparato mitótico hala hace que las cromátidas migren hacia polos opuestos, a los extremos de los cromosomas se les denomina telómeros.
Nombre de los brazos
p
Del centrómero hacía arriba
q
Del centrómero hacia abajo
Tipos de cromosomas
Metacéntricos
p = q
1, 3, 19, 20
Submetacéntricos
p < q
2, 4, 5, 6, 7, 8, 9, 10, 11, 12, 16, 17, 18, X
Acrocéntricos
p << q
13, 14, 15, 21, 22, Y
Alteraciones en el número
Monosomías
Solo un representante de un cromosoma
Disomías
2 representantes de un cromosoma (es lo normal)
Podría ocurrir una disomía uniparental
Trisomías
3 representantes de un cromosoma
Cariotipo
Constitución cromosómica de una célula
Tiempos de duración del ciclo
Depende de la célula
Tiempos comunes
G1
3-5 h
S
7-8 h
G2
3-5 h
M
1h
Cuales células se dividen y cuales no
Las que alcanzan la diferenciación y ya no se vuelven a dividir.
Las que alcanzan la diferenciación, pero hay estímulos que inician el proceso de división.
Estímulos externos
Ruta estimuladora
Por ligandos que son factores de crecimiento
Ruta inhibidora
Por ligandos que son factores inhibidores de crecimiento.
Estímulos internos
Proteínas que permiten el progreso del ciclo.
- Cinasas dependientes de ciclinas (CDK)
- Ciclinas que se unen a CDK
Proteínas que inhiben el progreso del ciclo.
- CIP: Inhibidoras de CDK'S (P16, P21, P27)
- Supresoras de tumores (P53, RB)
Las que permanentemente se están dividiendo.
Puntos de control y restricción
La proteína E2F suelta indica división celular
puntos de restricción
G1
E2F se mantiene agarrada por RB (se llama así por retinoblastoma), en este momento del ciclo (G1) está presente la ciclina D, esta con conjunto con la CDK hiperfosforila a RB y RB suelta a E2F, la pareja Ciclina D - CDK es regulada por P16 que se les pega e inhibe. Ocurre en G1 antes del primer punto de control.
Puntos de control
G1
Una CDK con la ciclina E, hiperfosforilan a RB para que suelte a E2F, el complejo ciclina E - CDK es inhibido con la P21, la P53 es como un vigilante, si P53 capta un error indica síntesis de P21
G2
Ocurre al final de G2, lo que se hace es revisar que todo esté bien, la ciclina que está presente es la ciclina B que va a participar en el complejo promotor de maduración para entrar en división, este punto de control se regula actuando sobre la ciclina B o el factor promotor de maduración, si todo está correcto se forma el factor promotor de maduración.
Metafase
Se hace los chequeos respectivos, que todo esté en orden, que los cromosomas todos se hayan unido por ambos lados al aparato mitótico y los centrómeros. aparece el complejo promotor de anafase.
En metafase el cromosoma está duplicado, compactado y unido por cohesina, si se fragmentan la cohesina se separan las cromátidas hermanas y se entra en anafase, la enzima que degrada la cohesina es la separasa la cual es controlada por securín que la inactiva, si se fragmenta securín queda libre separasa, el complejo que fragmenta a securín se llama complejo promotor de anafase, este es activado por la quinasa CDC20, cuando el complejo se activa provoca la ubiquitinación de securín, es destruido y suelta a separasa que va a romper las cohesinas, se llega a la anafase, este tercer punto de control se puede regular impidiendo que se una CDC 20 al complejo promotor de anafase o haciendo que no se ubiquitine securín.