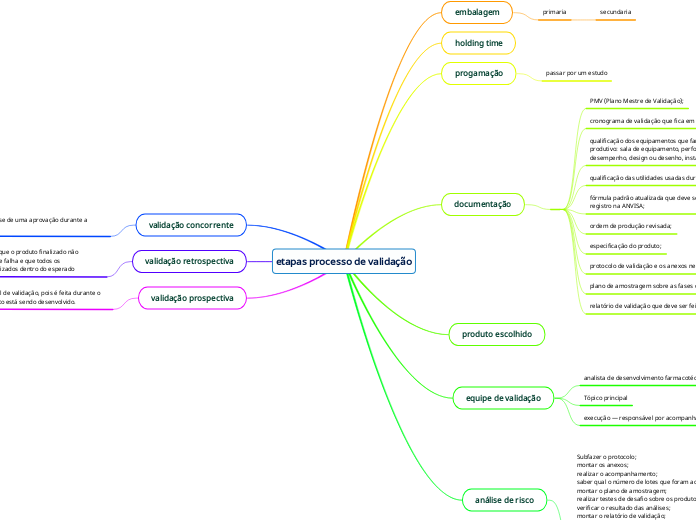
etapas processo de validação
embalagem
primaria
secundaria
holding time
progamação
passar por um estudo
documentação
PMV (Plano Mestre de Validação);
cronograma de validação que fica em anexo ao Plano Mestre;
qualificação dos equipamentos que farão parte do processo produtivo: sala de equipamento, performance ou desempenho, design ou desenho, instalação e operação;
qualificação das utilidades usadas durante o processo;
fórmula padrão atualizada que deve ser entregue com o registro na ANVISA;
ordem de produção revisada;
especificação do produto;
protocolo de validação e os anexos necessários;
plano de amostragem sobre as fases do processo produtivo;
relatório de validação que deve ser feito ao final do estudo.
produto escolhido
equipe de validação
analista de desenvolvimento farmacotécnico
Tópico principal
execução — responsável por acompanhar todas
análise de risco
Subfazer o protocolo;
montar os anexos;
realizar o acompanhamento;
saber qual o número de lotes que foram acompanhados;
montar o plano de amostragem;
realizar testes de desafio sobre os produtos;
verificar o resultado das análises;
montar o relatório de validação;
analisar as estatísticas;
fazer avaliação contínua do processo;
comunicação final sobre a conclusão da validaçãotópico
validação concorrente
é a mais comum e trata-se de uma aprovação durante a produçao
validação retrospectiva
uma maneira de mostrar que o produto finalizado não apresenta qualquer tipo de falha e que todos os procedimentos foram realizados dentro do esperado
validação prospectiva
visto como a forma ideal de validação, pois é feita durante o estágio no qual o produto está sendo desenvolvido.