Leyes fundamentales de la química
Leyes Ponderales
Ley de Proust (ley de las proporciones definidas)
La masa de los reactivos y la
masa de los productos son lo
mismo en una reacción química

Ley de Lavoisier (ley de conservación de la masa)
Cuando 2 o más elementos se combinan
para formar un compuesto determinado,
lo hacen en una relación de masas
constante.

Ley de Dalton (ley de las proporciones múltiples)
Un compuesto químico puro
tiene la misma composición
centesimal, por eso, el porcentaje
en masa toma un valor fijo.

Leyes volumétricas
Ley de Gay-Lussac (ley de los volúmenes de combinación)
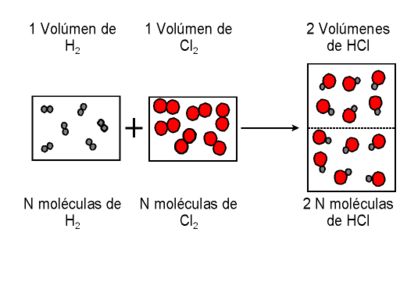
Los volúmenes de los reactivos y productos gaseosos (de una reacción y medidos por las mismas condiciones de P y T), tendrán entre ellos una relación de números enteros sencillos.
Hipótesis de Avogadro

Volúmenes iguales de gases diferentes (en las mismas condiciones de P y T), tienen el mismo número de partículas. Añadiendo el que los gases pueden formarse por moléculas.