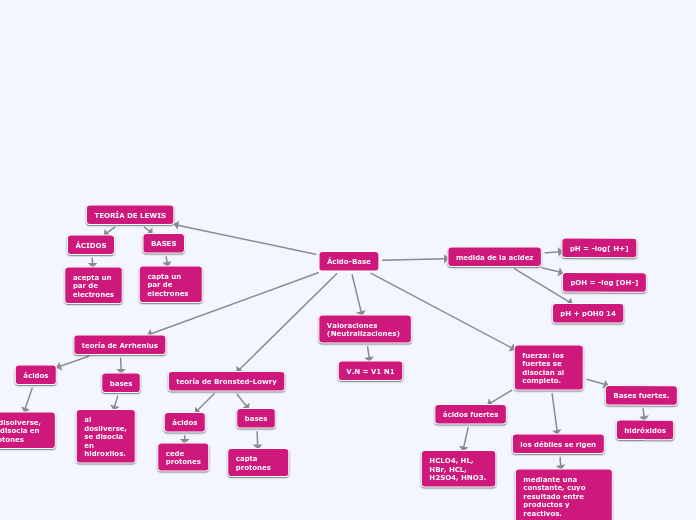
Ácido-Base
medida de la acidez
pOH = -log [OH-]
pH = -log[ H+]
pH + pOH0 14
fuerza: los fuertes se disocian al completo.
Bases fuertes.
hidróxidos
los débiles se rigen
mediante una constante, cuyo resultado entre productos y reactivos.
ácidos fuertes
HCLO4, HL, HBr, HCL, H2SO4, HNO3.
Valoraciones (Neutralizaciones)
V.N = V1 N1
TEORÍA DE LEWIS
ÁCIDOS
acepta un par de electrones
BASES
capta un par de electrones
teoría de Bronsted-Lowry
bases
capta protones
ácidos
cede protones
teoría de Arrhenius
ácidos
al disolverse, se disocia en protones
bases
al dosilverse, se disocia en hidroxilos.