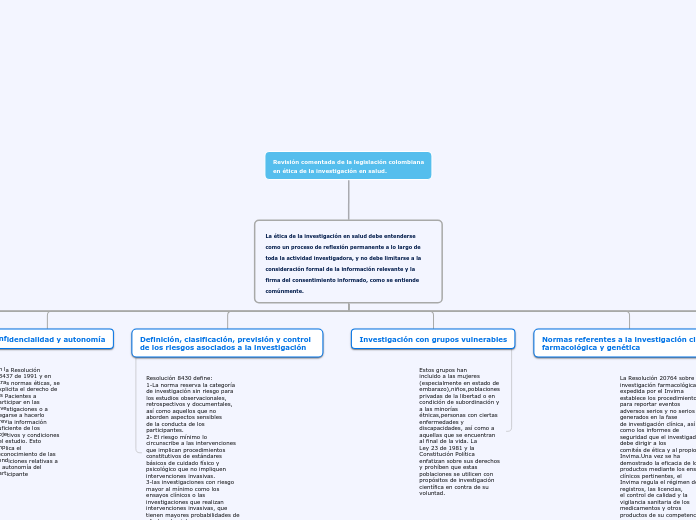
La ética de la investigación en salud debe entenderse como un proceso de reflexión permanente a lo largo de toda la actividad investigadora, y no debe limitarse a la consideración formal de la información relevante y la firma del consentimiento informado, como se entiende comúnmente.
Constitución Política de Colombia:
de los principios y derechos
La Constitución también define la organización del estado y las instituciones relacionadas en diferentes territorios con base en el principio de descentralización. Asimismo, confiere al Ministerio de Salud y Protección Social la función de dictar políticas y normas de ética en la investigación, orientadas a proteger la vida, integridad y dignidad de los participantes y el disfrute de sus derechos y libertades.
Normas básicas que regulan la ética de la
investigación en Colombia
En Colombia, la Resolución 8430 de 1993 es la norma marco para la investigación en salud. No
existe una norma con fuerza de ley que se ocupe de los temas importantes en la actualidad de bioética, especialmente en temas relacionados con la ética de la investigación en salud, a pesar de la proliferación de investigaciones en este campo y con ello un aumento de los riesgos poblacionales.
Marco epistémico, tipos de investigación y
contenidos
En cuanto al tipo de investigación considerada, establece los principios rectores de la investigación básica
Y clínico, y proporcionó algunos datos muy preliminares.
Guía de investigación y desarrollo
Salud pública, salud comunitaria y campos relacionados.
En cuanto al contenido, esta norma se refiere a algunos desarrollos tecnológicos y científicos
Correspondiente al tiempo de su expedición; En este sentido, ha establecido investigaciones farmacológicas relevantes, investigaciones organizacionales y
Componentes biológicos, radioisótopos y equipos que generan ionización y radiación electromagnética,animales, tambien a investigación con elementos como los recursos profilácticos, de diagnóstico, terapéuticos
y de rehabilitación, así como con microorganismos patógenos o material biológico.
Comités de ética y entidades regulatdoras
La Resolución 8430 de 1993, expedida como reglamentación de la operación del antiguo Sistema
Nacional de Salud, designa a los comités de ética de la investigación, al Invima (en los casos de investigación clínica o de alto riesgo) y al Ministerio de Salud como entidades encargadas de aprobar los protocolos y de resolver los problemas y dilemas éticos que surjan alrededor de la investigación en la salud.
Principios
En cuanto a los principios, la resolución enfatizó
Proteger a los sujetos de riesgos o daños derivados de la investigación y determinar la importancia de la distribución equitativa,
Proteccion de su privacidad, anonimato,el derecho al saber, el derecho a la autonomía y la libertad,
Todas las condiciones que deben ser cumplidas por el personal que participa en la investigación y deben ser acordadas explícitamente en el formulario de consentimiento informado.
Ética profesional y talento humano
Existen dos factores importantes: 1-Idoneidad profesional
2- el comportamiento esperado de los profesionales
En el desarrollo de su trabajo.
Las actividades de investigación necesitan talento de verdad es decir contar con personas técnicamente capacitadas. Es función del comité de ética de la investigación garantizar que
los talentos sean suficientes buenos para que cumplan con las condiciones y necesidades de la investigación.
Confidencialidad y autonomía
En la Resolución
13437 de 1991 y en otras normas éticas, se
explicita el derecho de los pacientes a participar en las investigaciones o a negarse a hacerlo
previa información suficiente de los objetivos y condiciones del estudio. Esto implica el reconocimiento de las condiciones relativas a la autonomía del participante
Definición, clasificación, previsión y control de los riesgos asociados a la investigación
Resolución 8430 define: 1-La norma reserva la categoría de investigación sin riesgo para los estudios observacionales, retrospectivos y documentales, así como aquellos que no aborden aspectos sensibles
de la conducta de los participantes. 2- El riesgo mínimo lo circunscribe a las intervenciones que implican procedimientos constitutivos de estándares básicos de cuidado físico y psicológico que no impliquen intervenciones invasivas. 3-las investigaciones con riesgo mayor al mínimo como los ensayos clínicos o las investigaciones que realizan intervenciones invasivas, que tienen mayores probabilidades de afectar al sujeto o que usan nuevas tecnologías.
Investigación con grupos vulnerables
Estos grupos han
incluido a las mujeres (especialmente en estado de
embarazo),niños,poblaciones privadas de la libertad o en condición de subordinación y
a las minorías étnicas,personas con ciertas
enfermedades y discapacidades, así como a aquellas que se encuentran al final de la vida. La
Ley 23 de 1981 y la Constitución Política enfatizan sobre sus derechos y prohíben que estas poblaciones se utilicen con propósitos de investigación científica en contra de su voluntad.
Normas referentes a la investigación clínica,
farmacológica y genética
La Resolución 20764 sobre investigación farmacológica expedida por el Invima
establece los procedimientos para reportar eventos
adversos serios y no serios generados en la fase
de investigación clínica, así como los informes de
seguridad que el investigador debe dirigir a los
comités de ética y al propio Invima.Una vez se ha demostrado la eficacia de los productos mediante los ensayos clínicos pertinentes, el
Invima regula el régimen de registros, las licencias,
el control de calidad y la vigilancia sanitaria de los
medicamentos y otros productos de su competencia.
Investigación con animales
En Colombia se permite el uso de animales en caso de que sean “imprescindibles para el estudio y avance de la ciencia, útiles para el control, la prevención, el diagnóstico o el tratamiento de enfermedades que afecten al hombre o al animal y solo cuando se demuestre que los resultados no puedan obtenerse por otros procedimientos”.
Aspectos éticos de la investigación genética y su impacto en el ambiente
En el mundo crece la oferta
de biobancos y centros de recursos biológicos y, con ello, también se han establecido normas en el ámbito internacional. Mediante los avances científicos, hoy es posible obtener embriones humanos clónicos, así como inducir la eugenesia a partir de las tecnologías de reproducción asistida.Esta posibilidad plantea problemas éticos de gran envergadura desde el punto de vista social,cultural y económico.
El consetimiento informado
Mediante el consentimiento informado los investigadores informan y pactan claramente con el participante las condiciones en las que se realizará el estudio que los ocupa En el caso de investigaciones comunitarias, la Resolución 8430 plantea la necesidad de obtener no solo el consentimiento informado de los individuos, sino también de las autoridades de salud, del representante legal de la institución investigadora y de la institución donde se realiza la investigación, así como de otras autoridades civiles de la comunidad.
Investigación con fuentes secundarias,
protección de datos personales y uso de las
tecnologías de la información y la comunicación
Las condiciones de anonimato, privacidad y
confidencialidad son ampliamente reconocidas en los tratados y normas de ética nacionales e internacionales, y en este contexto en el país se expidió la ley estatutaria para la protección de datos personales sancionada mediante la Ley 1581 del 2012 y reglamentada por el Decreto nacional 1377 del 2013. La protección de los datos personales se suma a la reglamentación sobre el acceso y el uso de los mensajes de datos por medios electrónicos reglamentados mediante la Ley 527 de 1999 que, para efectos jurídicos, cumplen la misma función que cualquier documento original siempre y cuando exista garantía confiable de que se ha conservado la integridad de la
información.
Transferencia de datos y muestras a otros países
La legislación colombiana no se ha pronunciado,
excepto para definir de forma genérica la posibilidad de que los componentes anatómicos
sean intercambiados con bancos y programas
de trasplantes de otros países cuando el fin sea
exclusivamente terapéutico y sin ánimo de lucro,y siempre y cuando el Ministerio de Salud otorgue
autorización especial y previa
Difusión del conocimiento
Colombia señaló que la publicación del artículo
Debe ajustarse estrictamente a los hechos científicos.
Debidamente verificados y de forma no engañosa.
Esta declaración es consistente con los principios de integridad científica, precisión, equidad, veracidad y honestidad descritos en las guias éticas de las ciencias biomédicas y sociales.
Retos normativos para la ética de la
investigación en salud
las normas colombianas tienen algunos vacíos en
temas de importancia contemporánea, como la
ética de la investigación en contextos de epidemia,
en situaciones de emergencias y de desastres y, en
general, de la investigación fisicoquímica y ambiental con repercusiones en el ecosistema, el hombre
y los animales.