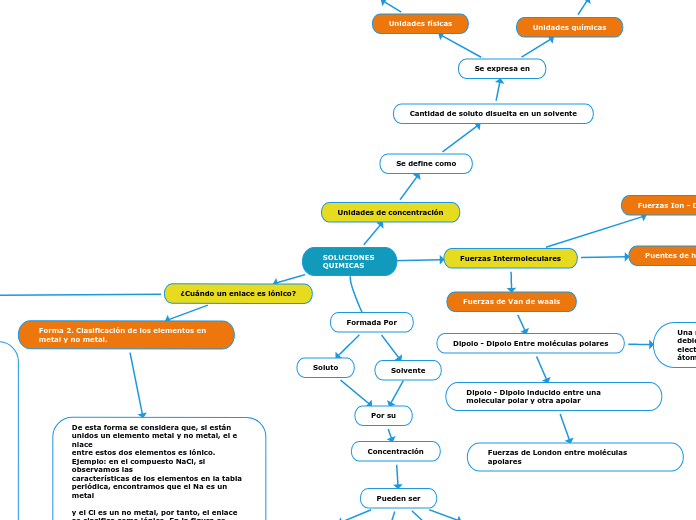
SOLUCIONES QUIMICAS
Formada Por
Solvente
Soluto
Por su
Concentración
Pueden ser
Concentrada
Sobresaturada
Saturada
Diluida
¿Cuándo un enlace es iónico?
Forma 1. Diferencia de electronegatividad de los elementos
enlazados
cuando la diferencia de
electronegatividad entre dos elementos es 1,7 entonces, el enlace
que forman tiene aproximadamente el 50 % de carácter iónico, si la
diferencia es mayor, el compuesto es fundamentalmente iónico, y si
es menor, covalente.
Ejemplo: determinar si el enlace NaCl es iónico o covalente.
Según la tabla periódica la electronegatividad de Na es 0,9 y la de
Cl es 3,0.
Diferencia de electronegatividad= ∆ En = 3,0-0,9
∆ En = 2,1
Forma 2. Clasificación de los elementos en metal y no metal.
De esta forma se considera que, si están unidos un elemento metal y no metal, el e nlace
entre estos dos elementos es iónico. Ejemplo: en el compuesto NaCl, si observamos las
características de los elementos en la tabla periódica, encontramos que el Na es un metal
y el Cl es un no metal, por tanto, el enlace se clasifica como iónico. En la figura se
muestra la división entre elementos metálicos, metaloides y no metales. El B, Si, Ge, As,
Sb, Te y Po se clasifican como metaloides.
Fuerzas Intermoleculares
Fuerzas de Van de waals
Dipolo - Dipolo Entre moléculas polares
Dipolo - Dipolo inducido entre una molecular polar y otra apolar
Fuerzas de London entre moléculas apolares
Una molécula se polariza
debido a la diferencia de
electronegatividad entre los
átomos que la constituyen.
Puentes de hidrogeno
Dipolo - Dipolo Entre enlaces polares N-H,O-H y F-H y un átomo de O, N o F. Se expresa como A-H.....B A y F son O,N o F.
Fuerzas Ion - Dipolo
Atracción entre un ion y una molécula polar. Responsables en la disolución de sales en el agua
Este tipo de interacción es
muy fuerte, por ello, la
mayoría de sustancias iónicas
se disuelven en sustancias
polares como el agua.
Unidades de concentración
Se define como
Cantidad de soluto disuelta en un solvente
Se expresa en
Unidades físicas
Como
% masa/masa
& volumen/volumen
% masa/volumen
Unidades químicas
Como
Molaridad
Molalidad
Normalidad