door Jesús Ramón Avilés Sauceda 5 jaren geleden
700
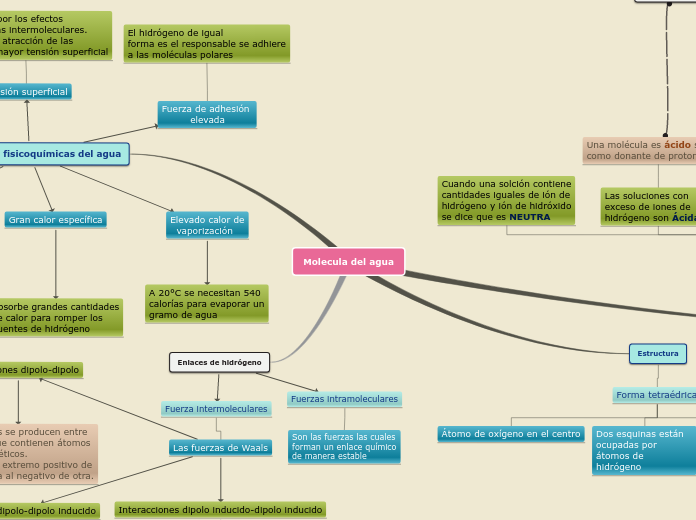
Molecula del agua
Esta es una muestra de mapa mental
door Jesús Ramón Avilés Sauceda 5 jaren geleden
700

Meer zoals dit
Interacciones dipolo inducido-dipolo inducido
El movimiento de los electrones en las moléculas apolares cercanas da lugar a un desequilibrio de carga transitorio en moléculas adyacentes. Son extremadamente débiles.
Interacciones dipolo-dipolo inducido
Un dipolo induce un dipolo transitorio en una molécula cercana al modificar su distribución electrónica. Estas interacciones son más débiles que las dipolo-dipolo.
Interacciones dipolo-dipolo
Estas fuerzas se producen entre moléculas que contienen átomos electromagnéticos. Dirigiendo el extremo positivo de una molécula al negativo de otra.
Amoritguador de proteínas
Formadas por aminoácidos unidos por enlaces péptídicos, son una fuente significativa de capacidad amortiguadora
Amortiguador de fosfato
Para amortiguar la sangre. Teniendo un pH de 7.4 encaja biem en la capacidad de amortiguar Teniendo un pH
Ayudan a mantener una concentración de iones de hidrógeno relativamente constante.
Ácidos débiles
La constante de disociación Kc es la medida de los ácidos débiles
No se disocian en su totalidad en el agua
Una molécula es básica si toma el lugar de aceptor
Una molécula es ácido si actúa como donante de protones