door Gabriela Mendez Perez 5 jaren geleden
1004
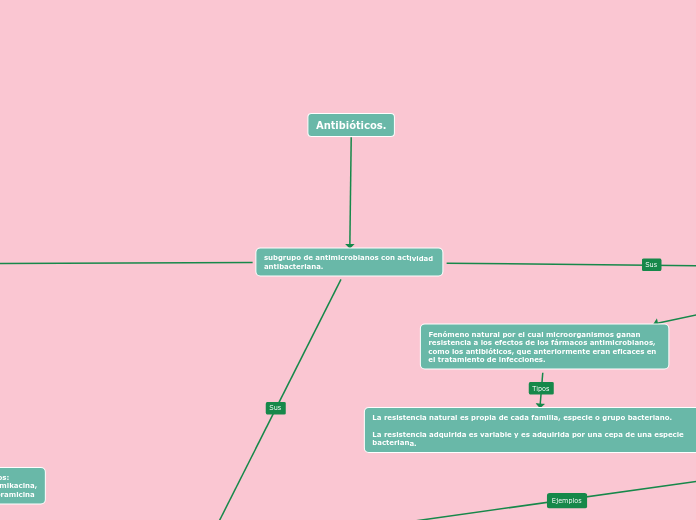
subgrupo de antimicrobianos con actividad antibacteriana.
door Gabriela Mendez Perez 5 jaren geleden
1004

Meer zoals dit
En 1952 Lederberg propuso cambiar el término de episoma a plásmido, limitando el uso para elementos extracromosomales que se integran al cromosoma. Se reconoció a partir de esto, que los plásmidos juegan un papel importante en la evolución bacteriana, en especial en transferencia de resistencia a antibióticos y patogenicidad.
Esther Lederberg.
En este tipo de resistencia adquirida se produce la transmisión de material genético extra cromosómico como plásmidos, transposones e integrones.
Un plásmido es una pequeña molécula de ADN circular que a menudo se encuentran en bacterias y otras células. Los plásmidos son separados del cromosoma bacteriano y se replican independientemente de ella.
Los plásmidos que transportan los genes de resistencia a los antibióticos se denominan plásmidos R.
Mecanismos de resistencia a los antibióticos que actúan sobre la pared bacteriana.
Peptidoglicano, actúa como una armadura o malla envolviendo la bacteria, ofreciéndole rigidez y estabilidad.
Inactivación enzimática
Interacciones entre fármacos antibacterianos.
Este fenómeno se puede dar al combinar un antibiótico bactericida con otro bacteriostático (betalactámicos junto con tetraciclinas) o al administrar dos antibióticos que actúen en el mismo lugar de acción, ya que compiten por la diana (cloranfenicol y macrólidos).
Modificación del lugar de acción del antibiótico.
Cambios estructurales en los lugares de acción ocasionan una menor afinidad por el antibiótico lo que genera una disminución de su eficacia clínica.
Disminución de la penetración del antibiótico al lugar de acción.
La bacteria se hace resistente al reducir la cantidad de antibiótico que penetra en el medio intracelular.
Este fenómeno es debido a una disminución de la permeabilidad (fosfomicina, ampicilina) o a la presencia de una bomba de expulsión activa (tetraciclina).
El principal mecanismo de inactivación es la hidrólisis, como sucede con las betalactamasas y los betalactámicos.
En este caso se producen cambios en la secuencia genómica que posibilitan la resistencia.
Se trata de mutaciones que presentan una transmisión vertical (se transmiten a la descendencia), aparecen de forma espontánea, son irreversibles y aparecen tras la administración del antibiótico.
Mecanismo de acción: Actúan inhibiendo la ADN girasa, enzima que cataliza el superenrollamiento del ADN cromosómico, que asegura una adecuada división celular.
La resistencia a quinolonas en bacterias gramnegativas está causada fundamentalmente por mutaciones cromosómicas.
Mecanismo de acción: Se unen a la subunidad 50S del ARN ribosómico en forma reversible.
El mecanismo de resistencia de eflujo activo ya ha sido mencionado y es mediado por plásmidos. Dos tipos de alteraciones del sitio blanco pueden producir resistencia a macrólidos
Mecanismo de acción. • Se unen de forma irreversible a la subunidad 30S del ribosoma, consiguiente bloqueo de la síntesis proteica de la bacteria. • Bactericidas de acción rápida (dpte CIM). • Tienen EPA. • Deben ingresar ala célula para actuar: entran a bact G - por porinas (limitantes: disminución del PH, anaerobiosis), incorporan aminoglucósidos en el interior de la bacteria, especialmente en los cocos grampositivos.
Mecanismos de resistencia: Inactivación enzimática, seguido por alteración de la permeabilidad, limitado a la estreptomicina y la espectinomicina, puede observarse una mutación puntual en el sitio de acción de estos agentes, la proteína de la subunidad 30s denominada proteína S12.
Mecanismos de acción. • Los glicopéptidos inhiben la síntesis y el ensamblado de la segunda etapa del peptidoglicano de la pared celular. • Alteran la permeabilidad de la membrana citoplasmática. • Altera la síntesis de ARN. • Sus múltiples mecanismos de acción contribuyen a la baja frecuencia de desarrollo de resistencia. Se une rápida y firmemente a las bacterias y ejerce su efecto bactericida.
Mecanismo de resistencia: Mecanismo inducible, que requiere la presencia de este antibiótico. El mecanismo se pone en funcionamiento mediante un sistema de traducción de señales de dos componentes: un péptido transmembrana denominado vanS y un segundo mensajero llamado vanR.
Inhibidores de la síntesis de la pared bacteriana. • Efecto autolítico. • Inhibición de la última parte de la síntesis de peptidoglicano. • Necesaria fase de multiplicación (síntesis de pared celular). • Acción de las PBP.
Mecanismo de resistencia. • Producción de betalactamasas: enzimas que hidrolizan anillo beta lactámico.
Penicilinas. Cefalosporinas. Monobactámicos. Carbapenems.
Tienen actividad microbiana sobre un grupo reducido de especies.
Cubren varios tipos de microorganismos pero no todas las especies de cada grupo.
• 1ª Generación: Ácido pipemídico • 2ª Generación: Norfloxacino, Ciprofloxacino. • 3ª Generación: Levofloxacino. • 4ª Generación: Moxifloxacino, Nadifloxacino.
Cefalosporinas • 1ª Generación • 2ª Generación: Cefaclor, Cefalexina, Cefalexina. • 3ª Generación: Cefazolina, Ceftriaxona, Ceftazidima, Cefixima. • 4ª Generación: Cefepime.
• Monobactámicos: Aztreonam • Carbapenemicos: Meropenem, Doripenem, Ertapenem.
Generados mediante síntesis química.
Sintetizados por organismos vivos. Penicilina, cloranfenicol.
Modificaciones químicas de moléculas sintetizadas por organismos vivos. Como ampicilina.