CICLO DE CARNOT
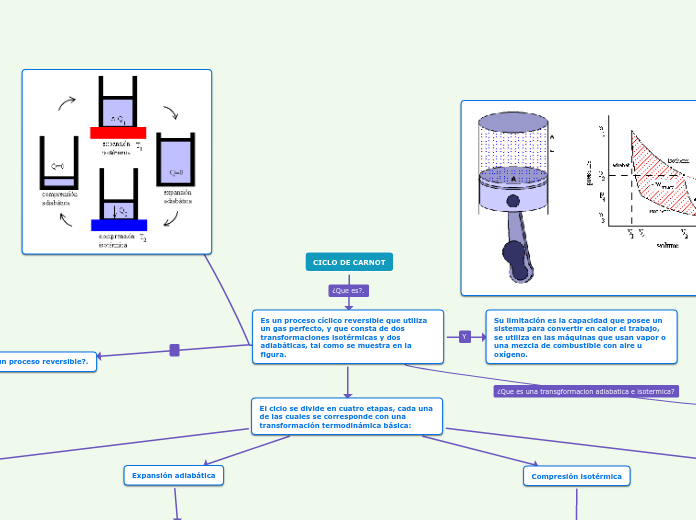
Es un proceso cíclico reversible que utiliza un gas perfecto, y que consta de dos transformaciones isotérmicas y dos adiabáticas, tal como se muestra en la figura.
Su limitación es la capacidad que posee un sistema para convertir en calor el trabajo, se utiliza en las máquinas que usan vapor o una mezcla de combustible con aire u oxígeno.
El ciclo se divide en cuatro etapas, cada una de las cuales se corresponde con una transformación termodinámica básica:
Expansión isotérmica
En el gráfico es el paso del estado 1 al estado 2. Es un proceso isotermo y por ser un gas perfecto eso hace que la temperatura se mantenga constante T1.
El gas se encuentra en un estado de equilibrio inicial representado por p1, V1, T1, en el interior del cilindro. Se produce una expansión isotérmica entre 1 y 2, hasta alcanzar los valores p2, V2, T1, el sistema realiza un trabajo W1 positivo (aumenta el volumen, luego es un trabajo hecho por el sistema, trabajo positivo), comunicando energía al entorno, por otro lado como la variación de energía interna ha de ser cero, toma un calor del entorno equivalente Q1:

Expansión adiabática
Se parte del punto 2 y se llega al estado 3.
Por ser un proceso adiabático no hay transferencia de calor, el gas debe realizar un trabajo, elevando el émbolo, para lo que el cilindro debe estar aislado térmicamente, alcanzándose los valores p3, V3, T2.
Compresión isotérmica
Entre los estados 3 y 4, hasta alcanzar los valores p4, V4, T2, siendo el trabajo realizado por el pistón. En este caso es un trabajo de compresión (negativo), se recibe energía del entorno en forma de trabajo y se cede una energía equivalente en forma de calor:

Compresión adiabática
Entre los estados 4 y 1 cerrándose el ciclo.
Se alcanzan de nuevo los valores p1, V1, T1 sin transferencia de calor con el exterior.
"ISOTERMICA"
"ADIABATICA"
Se define el coeficiente adiabático de un gas (γ) a partir de las capacidades caloríficas molares tomando distintos valores según el gas sea monoatómico o diatómico: En una transformación adiabática no se produce intercambio de calor del gas con el exterior (Q = 0).
Es una transformación termodinámica a temperatura constante, es decir, una variación del estado de un sistema físico durante el cual la temperatura del sistema no cambia con el tiempo.
¿Que es un proceso reversible?.
Un proceso reversible se define como un proceso que se puede revertir induciendo cambios infinitesimales en alguna propiedad del sistema, y al hacerlo no deja ningún cambio ni en el sistema ni en el entorno. Durante el proceso reversible, la entropía del sistema no aumenta y el sistema está en equilibrio termodinámico con su entorno.
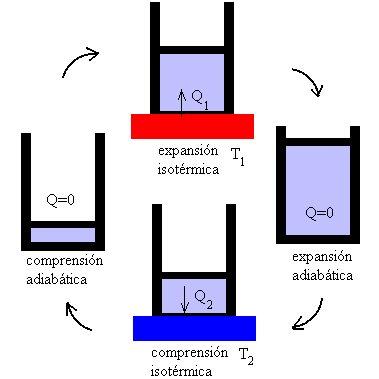

Consideramos ahora el efecto global del ciclo.
El trabajo neto W realizado durante el ciclo por el sistema será el representado por la superficie encerrada en el trayecto 1-2-3-4-1.
La cantidad neta de energía calorífica recibida por el sistema será la diferencia entre Q2 y Q1.
Para calcular el rendimiento de un ciclo de Carnot se emplea la misma expresión mencionada anteriormente: