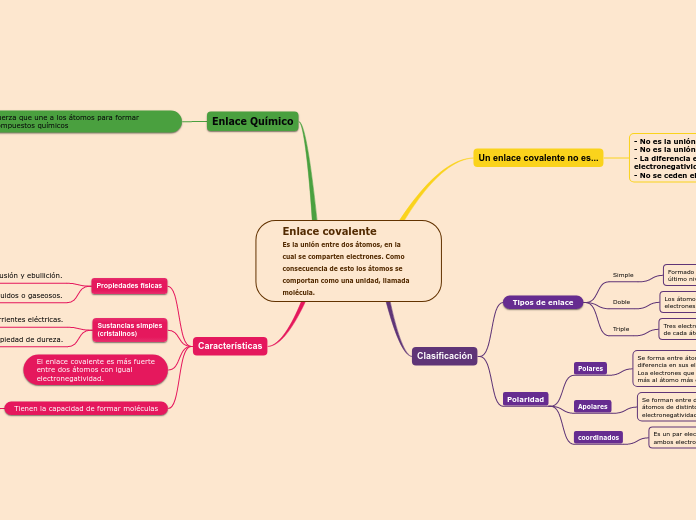
Enlace covalente Es la unión entre dos átomos, en la cual se comparten electrones. Como consecuencia de esto los átomos se comportan como una unidad, llamada molécula.
Un enlace covalente no es...
- No es la unión de un (metal + no metal). - No es la unión de un (metal + metal). - La diferencia entre sus electronegatividades no es mayor a 1,7. - No se ceden electrones entre los átomos.
Clasificación
Tipos de enlace
Simple
Formado por un electrón perteneciente al
último nivel de energía de cada átomo.
Ácido clorhídrico (H-Cl)
Doble
Los átomos enlazados aporta cada uno dos
electrones de su última capa de energía.
Monóxido de carbono (C=O)
Triple
Tres electrones pertenecientes al último nivel de energía de cada átomo y se representa con tres líneas paralelas.
Propino (CH3C≡CH)
Polaridad
Polares
Se forma entre átomos no metálicos que poseen una diferencia en sus electronegatividades entre 0,4 y 1,7. Loa electrones que se comparten tienden a aproximarse más al átomo más electronegativo.
Una molécula de agua (H2O)
Apolares
Se forman entre dos átomos del mismo elemento o entre átomos de distintos elementos con una diferencia de electronegatividad igual o menor que 0,4.
Una molécula de Cloro (CL2)
coordinados
Es un par electrónico compartido por dos átomos pero ambos electrones son aportados por un mismo átomo.
Óxido de azufre (SO3)
Enlace Químico
Fuerza que une a los átomos para formar compuestos químicos
Características
Propiedades físicas
Bajas temperaturas de fusión y ebullición.
Pueden ser sólidos, líquidos o gaseosos.
Sustancias simples
(cristalinos)
Aislantes de corrientes eléctricas.
Tienen la propiedad de dureza.
El enlace covalente es más fuerte
entre dos átomos con igual
electronegatividad.
Tienen la capacidad de formar moléculas
H2O (dos enlaces simples)
HCl (un enlace simple)