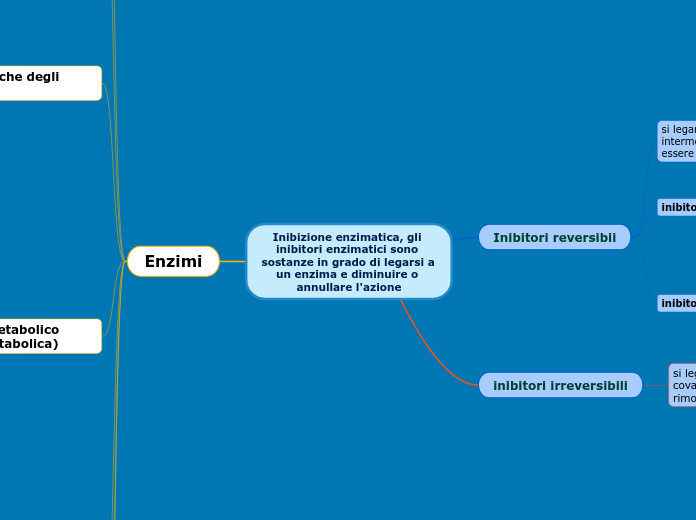
Inibizione enzimatica, gli inibitori enzimatici sono sostanze in grado di legarsi a un enzima e diminuire o annullare l'azione
Enzimi
Cosa sono?
Proteine che svolgono funzioni di catalisi, accelerano le reazioni chimiche.
Catalizzatori biologici.
La maggioranza degli enzimi è costituita da proteine globulari idrosolubili.
il ruolo di un enzima consiste nel facilitare le reazioni attraverso attraverso l'interazione tra il substrato (la molecola o o le molecole che partecipano alla reazione) il proprio sito attivo ( la parte di enzima in cui avvengono le reazioni), formando un complesso.
avvenuta la reazione, il prodotto viene allontanato dall' enzima, che rimane disponibile per iniziarne una nuova. l'enzima infatti non viene consumato durante la reazione.
Modelli di funzionamento
1. Modello Chiave-serratura
il substrato si inserisce come una chiave nel enzima perchè possiede la forma adatta, svolgono la reazione chimica che forma i prodotti.
2.Modello Adattamento indotto
(Più complicato), prevede che l'enzima e il substrato in parte si modificano strutturalmente per adattarsi l'un l'altro, svolgono la reazione chimica che forma i prodotti.
Caratteristiche degli enzimi
la loro funzione dipende dalla struttura terziaria, se un enzima viene denaturato, perde la capacità di catalizzare.
ogni enzima è specifico (cioè in grado di catalizzare una reazione o poche reazioni).
il riconoscimento tra substrato e sito attivo dipende dalla reciproca interazione in cariche elettriche, zone idrofobiche, formazioni di legami idrogeno.......
Possono necessitare di un fattore alternativo: 1. Coenzima(molecola biologica); 2. Cofattore( molecola inorganica ad esempio ione metallico).
il loro funzionamento dipende dalla struttura terziaria cioè dalla forma tridimensionale, se viene denaturato (perde la struttura della forma) quindi anche la capacità di catalizzare.
Pathway metabolico (catena metabolica)
una della caratteristiche più importanti degli enzimi è la possibilità di lavorare in successione, creando un pathway metabolico.
nei pathway, ogni enzima utilizza il prodotto della reazione precedente come substrato.
i passaggi fondamentali di un pathway sono quelli regolati più finemente.
Regolazione dell'attività enzimatica
controllo sulla produzione dell' enzima
bloccare o accelerare la produzione dell'enzima controllando la trascrizione di rna o la traduzione di proteina.
compartimentalizzazione dell'enzima
compartimentalizzarlo( inserirlo all interno di vescicole e impedire che agisca al di fuori questi.
Feedback negativo
regolazione da parte di un prodotto della via metabolica che va a bloccare un enzima della stessa via.
i prodotti finali di un pathway metabolico sono spesso inibitori degli enzimi chiave delle stessa via metabolica.
la quantità di prodotto generato dipende dalla concentrazione del prodotto stesso.
i meccanismi di feedback sono in grado di regolare finemente l'attività degli enzimi in base alle necessità della cellula, permettendo una ottimizzazione della gestione dei metaboliti a disposizione e un corretto mantenimento dell' omeostasi.
modificazioni post- traduzionali
modifiche che possono essere fatte al livello chimico a determinati enzimi e che modificano la loro capacità di essere attivi o spenti, determinano se l'enzima funziona di più o di meno o se proprio si spegne e non svolge più la sua funzione.
Effetto della temperatura sugli enzimi
gli enzimi se sono ad alta temperatura si denaturano.
gli enzimi se sono a bassa temperatura sono inattivi.
Efficienza catalitica
è espressa come numero di turnover ( numero di molecole di substrato trasformate in prodotto da una molecola di enzima nel tempo di un secondo/ in condizioni ottimali); la catalasi è l'enzima con la più elevata attività catalitica.
Inibitori reversibii
si legano tramite legami deboli intermolecolari e posso quindi essere rimossi.
inibitori competititvi
occupano il sito attivo impedendo al substrato di legarsi correttamente.
spesso gli inibitori competititvi hanno una forma simile a quella del substrato.
inibitori non competitivi
legano siti diversi dal sito attivo, chiamati siti allosterici.
il loro legame all'enzima genera un cambiamento conformazionale dell'enzima stesso, che può avere come conseguenza l'inibizione del legame tra enzima e substrato.
inibitori irreversibili
si legano tramite legami covalenti e non possono essere rimossi.