Kén és vegyületei

Kén
Kén (S8) tulajdonságai:A kén sárga színű.Szilárd anyag.Nyolcatomos (S8) molekulákból épül felKét allotróp módosulata van: a rombos kén és a monoklin kén. (Kristályszerkezetükben különböznek egymástól.)A kén a természetben elemi állapotban is előfordul.Oxigénhez hasonlóan hat vegyértékelektronja van --> Két kovalens kötés kialakításával nemesgázszerkezet érhet el.Kén atomok között egyszeres kovalens kötések alakulnak ki.Molekularácsos kristály.Molekulákat a kristályrácsban gyenge másodrendű kötések tartják össze. (Melegítésre felszakadnak.)Alacsony olvadáspontja van Felhasználása:Kénsavgyártásgumigyártásborászatnövényvédő szerekElterjedt vegyületei:GipszkristályPiritkristályRéz-szulfát kristály

A kén kétszer olvad meg ?
Kétszer olvad meg a kén?Szobahőmérsékleten stabilis módosulata a rombos kén. A molekularácsban az S8-gyűrűk rendezve találhatók. Melegítés hatására először megváltozik a kristályrács szerkezete, kialakul a monoklin kén. Elérve az olvadáspontot (114 °C) hígan folyó, sárga színű olvadékot kapunk, amelyben gyűrű alakú S8-molekulák vannak. További melegítésre az olvadék színe egyre sötétebb lesz, egyre sűrűbben folyóvá válik, és egyszer csak „megszilárdul”. Melegítés hatására ugyanis az S8-gyűrűk felszakadnak, és a képződő zegzugos S8-láncok összegabalyodnak. Ha még ezek után is folytatjuk a melegítést, az S8-láncok kisebb darabokra töredeznek, így a kén ismét megolvad. A hígan folyó kén forrni kezd.

Kísérlet

Tudtad-e?
Hogyan fehérítettek ruhát az ókorban?"Az ókori görögök és rómaiak előszeretettel viseltek fehér vászonruházatot. Ezek tisztítására, fehérítésére, a rájuk került színes foltok eltávolítására a már akkor is ismert ként használták. A fonott kosárra kiterített nedves ruha alatt ként égettek. A képződött kén-dioxid a színes foltok többségét elszíntelenítette."
Al topik

Kén reakciói
Kén kémiai tulajdonságai, reakciók:Könnyen meggyújtható. Égése során kén-dioxid-gáz keletkezikS+O2=SO2Nemcsak oxigénnel, hanem más nemfémekkel is egyesül.Illetve reakcióba lép a legtöbb fémmel.Fe +S = FeSZn + S = ZnSA kén reakcióba lép a fémekkel, hogy a fématomoktól elektront vesz át. Szulfidok keletkeznek. (Exoterm folyamat)

Kén-dioxid
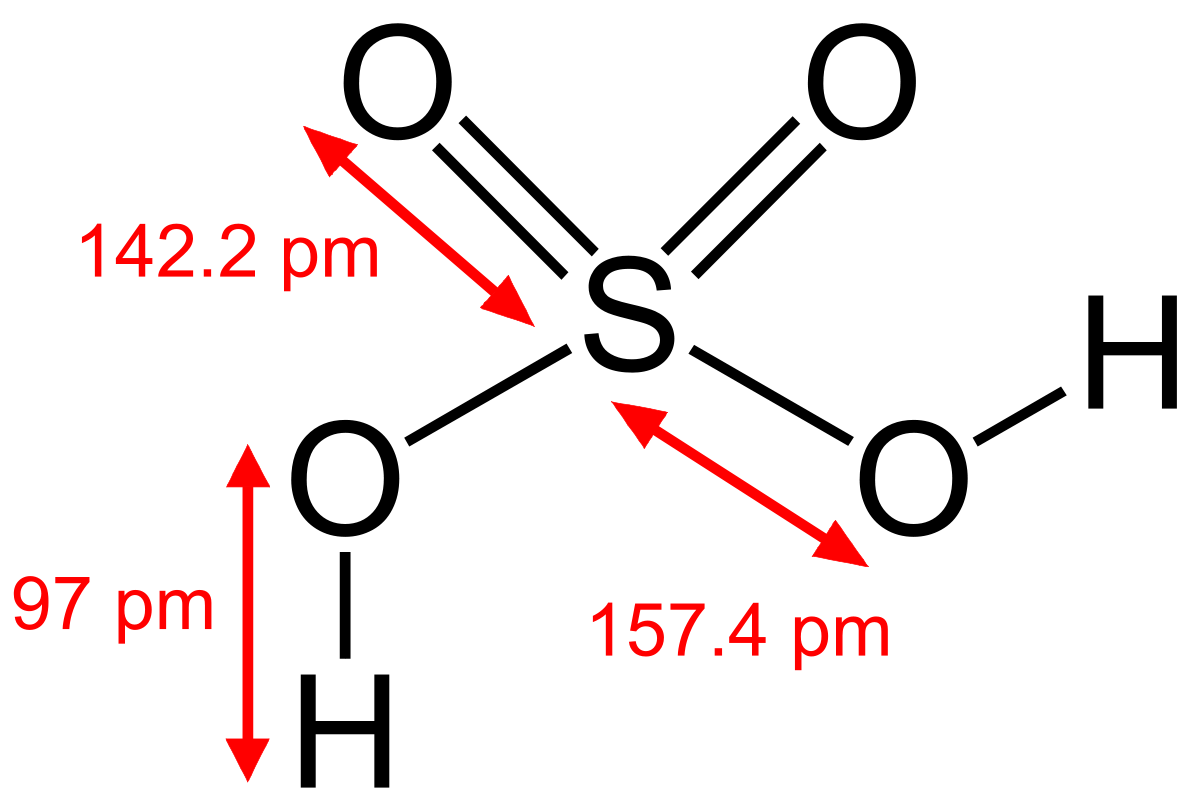
Kén-dioxid (SO2 ):Szúrós szagú, köhögésre ingerlő, a levegőnél nagyobb sűrűségű gáz.Vízben jól oldódik.Vizes oldata savas kémhatású, és benne kénessav-molekulák (H2SO3) is találhatók.Jó redukálószer.Erős méreg.Gombaölő hatása miatt tartósításra is használják.Benne a kén atom oxidációs száma +4.V alakú dipólusos molekula.
Reakciója vízzel
Könnyen reakcióba lép a vízzel:SO2+H2O = H2SO3Kén-dioxid + víz = kénessavA kén-dioxid és a kénessav redukáló hatású. A kénessav bomlékonysága miatt csak vizes oldatban létezik. (Sóit szulfitoknak nevezzük.)
Kén-dioxid színtelenítő hatása

Kén-hidrogén
Kén-hidrogén (H2S):kellemetlen, záptojásszagú vegyületKéntartalmú vegyületek (pl. fehérjék) bomlásakor keletkezik.Erős méreg.(Szaga miatt nagyon kis koncentrációban is érzékelhető.)Sói szulfidok.Éghető gáz
Reakciója jóddal
A kén-hidrogén vizes oldatának reakciója a jóddal:H2S+ I2 =2HI + SEkkor a kén-hidrogénből elemi kén válik ki.
Kén-hidrogén előállítása
Kénsav
Kénsav(H2SO4):A tömény kénsav erős oxidálószer és vízelvonószera híg kénsav pedig erős sav.A kénsav sói a szulfátok pl.:keserűsó (MgSO4)rézgálic (CuSO4)gipsz (CaSO4),A kénsavat kénből gyártják: Kén égetésével kén-dioxidotTovábbi oxidációjával kén-trioxidotVégül vízzel való reakcióval kénsavat állítanak elő:S → SO2 → SO3 → H2SO4

Mit öntsünk mibe?
A tömény savak és hígítása általában felmelegedéssel jár.A kénsav esetében ha :Vizet öntünk a tömény kénsavba, akkor a hirtelen fejlődő hőtől a víz gőzzé alakul, és kifröccsen a tömény kénsav.Ez életveszélyes sérüléseket okozhat. Ezért HELYESEN mindig a kénsavat kell lassan, üvegbot mellett töltve, kevergetés és esetleg hűtés közben lassan adagolni vízhez.
kísérletek
Kénsav + cukor
Kénsav reakciója papírral, fával
Használati útmutató
A gondolattérképrőlKiknek?Elsősorban 9. osztályos szervetlen kémiát tanuló diákok számára készült. Egy összefoglaló gondolattérkép a kén és vegyületeiről.Használat:Az egyes főbb elágazásoknál találhatóak leírások ezekre vagy duplán kattintva vagy az egeret rávíve láthatjuk a leírásokat, esetleg kommenteket. Megtalálhatóak olyan alpontok amelyekhez youtube linkek vannak csatolva azokra kattintva egyből a videó megnézhető.Célja:A kénnel és azok vegyületeivel kapcsolatos tudnivalók összegzése, a gondolkodás segítése és a diákok motiválása.Google feladatsor:A gondolattérkép áttanulmányozása után lehetőség van egy feladatsor kitöltésére, tanárok esetleg kiadhatják egy otthoni munkának. Illetve a diákok ezzel ellenőrizhetik a tudásukat is.Tanári segédlet a feladat megoldáshoz:https://docs.google.com/document/d/1h6v-m4UMY3RIi_IhMbUiLDiw55jbL9vDCcaZDnevO64/editA feladatsor végén található egy kvíz a témával kapcsolatban.
Források
Felhasznált irodalom:Kémia 9. Szervetlen kémia, Mozaik Kiadó, 2012OFI Kémia 9. Eszterházy Egyetem, 2017Tudásbázis, A kén tulajdonságai https://tudasbazis.sulinet.hu/hu/termeszettudomanyok/kemia/szervetlen-kemia/nemfemes-elemek/a-ken-tulajdonsagai-es-jelentosege
a