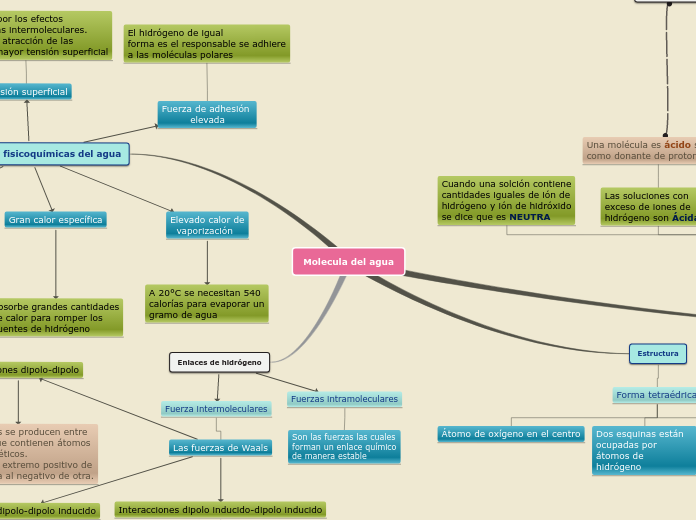
Molecula del agua
Ionización del agua
Las moléculas de agua en líquido poseen una capacidad limitada de ionización para formar un protón, ión de hidrógeno y ión hidroxido.
Cuando una solción contiene
cantidades iguales de ión de
hidrógeno y ión de hidróxido
se dice que es NEUTRA
Las soluciones con exceso de iones de
hidrógeno son Ácidas
Una molécula es ácido si actúa
como donante de protones
Las soluciones con exceso
de iones de hidróxido son
BÁSICAS
Una molécula es básica si toma
el lugar de aceptor
Amotiguadores
Ayudan a mantener
una concentración de
iones de hidrógeno relativamente
constante.
Ácidos débiles
No se disocian en su totalidad en el agua
La constante de disociación
Kc es la medida de los ácidos débiles
Amortiguador de fosfato
Para amortiguar la sangre.
Teniendo un pH de 7.4 encaja biem
en la capacidad de amortiguar
Teniendo un pH
Amoritguador de proteínas
Formadas por aminoácidos unidos por enlaces péptídicos, son una fuente significativa de capacidad amortiguadora
Estructura
Forma tetraédrica
Átomo de oxígeno en el centro
Dos esquinas están ocupadas por átomos de
hidrógeno
En las otras dos esquinas están
los pares de eletrónes no apareados
Propiedades fisicoquímicas del agua
Acción disolvente
El agua es el solvente universal
debido a su característica polar y
su capacidad de formar puentes de
hidrógeno
Fuerza de cohesión
elevada
Los puentes de hidrógeno mantienen
a la molécula unida de manera fuerte
Fuerza de adhesión
elevada
El hidrógeno de igual
forma es el responsable se adhiere
a las moléculas polares
Gran calor específica
Absorbe grandes cantidades
de calor para romper los
puentes de hidrógeno
Elevado calor de
vaporización
A 20°C se necesitan 540
calorías para evaporar un
gramo de agua
Tensión superficial
Es causada por los efectos
de las fuerzas intermoleculares.
Entre mayor atracción de las
moléculas, mayor tensión superficial
Enlaces de hidrógeno
Fuerza intermoleculares
Las fuerzas de Waals
Interacciones dipolo-dipolo
Estas fuerzas se producen entre
moléculas que contienen átomos
electromagnéticos.
Dirigiendo el extremo positivo de
una molécula al negativo de otra.
Interacciones dipolo-dipolo inducido
Un dipolo induce un dipolo transitorio
en una molécula cercana al modificar
su distribución electrónica.
Estas interacciones son más débiles
que las dipolo-dipolo.
Interacciones dipolo inducido-dipolo inducido
El movimiento de los electrones en las
moléculas apolares cercanas da lugar a un desequilibrio de carga transitorio
en moléculas adyacentes. Son extremadamente débiles.
Fuerzas intramoleculares
Son las fuerzas las cuales
forman un enlace químico
de manera estable