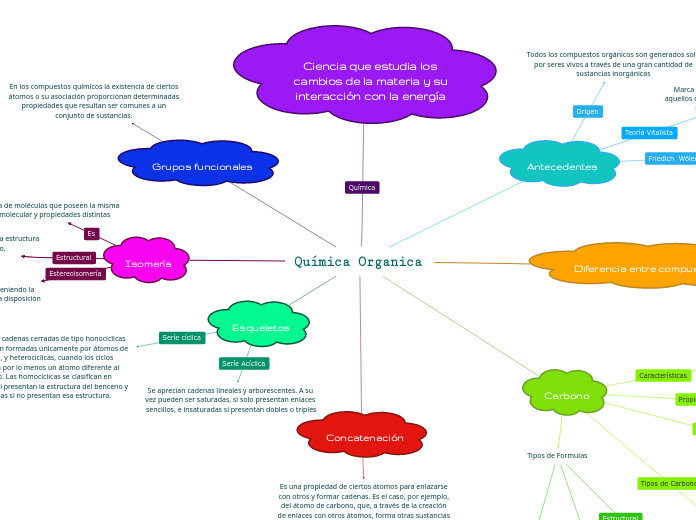
Química Organica
Isomería
La existencia de moléculas que poseen la misma fórmula molecular y propiedades distintas
Es aquella que presenta diferencias en la estructura del esqueleto hidrocarbonado.
Presentan aquellos compuestos que teniendo la misma fórmula estructural difieren en la disposición espacial de sus átomos.
Ciencia que estudia los cambios de la materia y su interacción con la energía
Esqueletos
Se presenta cadenas cerradas de tipo honocíclicas las cuales son formadas únicamente por átomos de carbono, y heterocíclicas, cuando los ciclos presentan por lo menos un átomo diferente al carbono. Las homocíclicas se clasifican en aromáticas si presentan la estructura del benceno y alicíclicas si no presentan esa estructura.
Se aprecian cadenas lineales y arborescentes. A su vez pueden ser saturadas, si solo presentan enlaces sencillos, e insaturadas si presentan dobles o triples
Carbono
Es la base de la vida en la Tierra, necesario para formar moléculas complejas como proteínas y ADN. Este elemento también se encuentra en la atmósfera en forma de dióxido de carbono (CO2).
Es una sustancia inerte, insoluble en agua, ácidos y bases diluidos, así como disolventes orgánicos. A temperaturas elevadas se combina con el oxígeno para formar monóxido o dióxido de carbono.
De acuerdo con el número de otros átomos de este elemento con los que se encuentre unido,
Cuando un átomo de carbono está unido a otro.
Cuando un átomo de carbono se encuentra unido a otros dos.
Un átomo de carbono unido a otros tres
Si un átomo de carbono se encuentra unido a otros d¿cuatro átomos de dicho elemento
Tipos de Formulas
Nos indica los diferentes elementos que componen la molécula y la relación entre ellos pero no nos indica la fórmula real del compuesto.
Representación de una molécula que utiliza símbolos químicos para indicar los tipos de átomos seguidos de subíndices para mostrar el número de átomos de cada tipo en la molécula.
Muestra la forma en que se unen los diferentes átomos para dar lugar a la molécula.
Símbolo: C, Familia: 14, Grupo IV4, Bloque P, Periodo: 2, Número Atómico: 6, Número de protones: 6, Número de electrones: 6, Número de neutrones: 6, Masa atómica: 12.011 u, Tipo de elemento: No metal, Configuración electrónica:
[He] 2s2 2p2, Número de electrones de Valencia: 9
Antecedentes
Todos los compuestos orgánicos son generados solo por seres vivos a través de una gran cantidad de sustancias inorgánicas
Marca la diferencia entre productos naturales y aquellos que podían fabricarse en un laboratorio así se dio lo orgánico y lo inorgánico.
En 1828, obtuvo la urea, la cual es el producto del metabolismo de las proteínas que hay en la sangre y es eliminado por la orina.
Diferencia entre compuestos
Se basan principalmente en carbono, en combinación con otros elementos. De forma general, encontramos carbono e hidrógeno, oxígeno, nitrógeno, azufre y fósforo.
Se forman con cualquier elemento de la tabla periódica.
Concatenación
Es una propiedad de ciertos átomos para enlazarse con otros y formar cadenas. Es el caso, por ejemplo, del átomo de carbono, que, a través de la creación de enlaces con otros átomos, forma otras sustancias orgánicas.
Grupos funcionales
En los compuestos químicos la existencia de ciertos átomos o su asociación proporcionan determinadas propiedades que resultan ser comunes a un conjunto de sustancias.