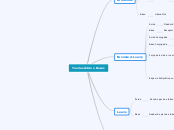
Teorias Ácido e Bases
Arrhenius
Em meio Aquoso
Ácido
Libera H+
Também representado por H3O+
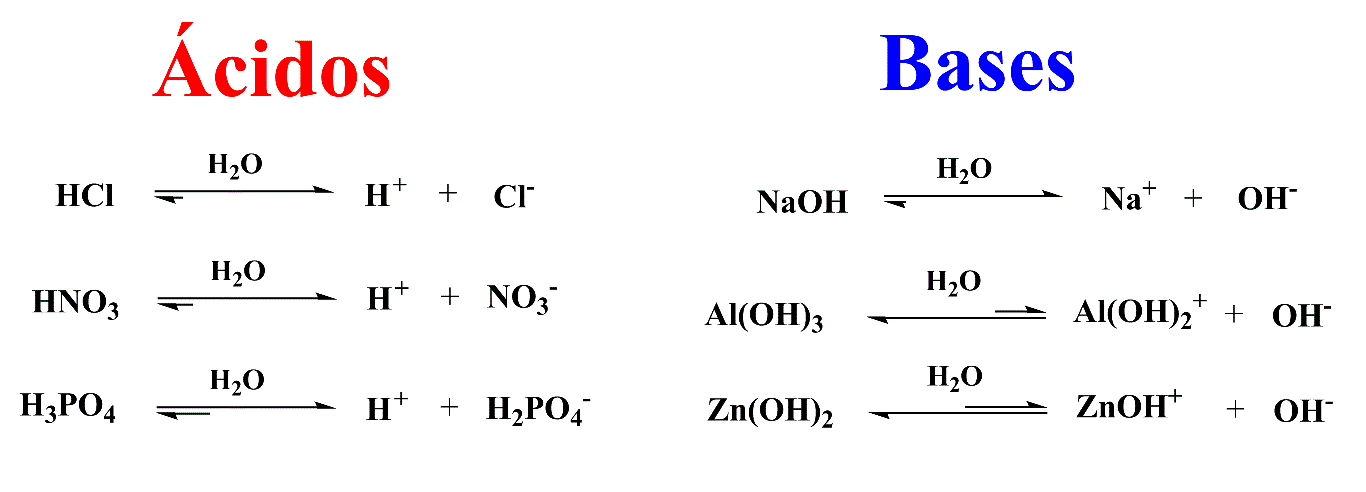
Base
Libera OH-
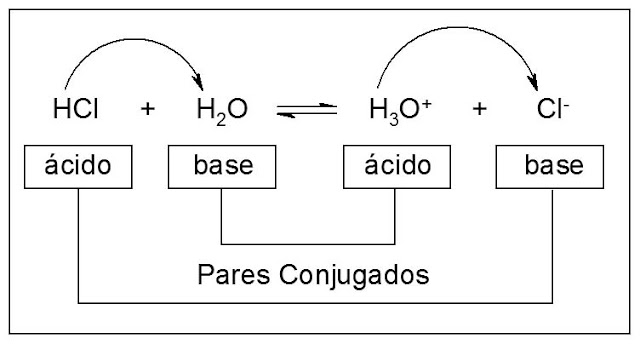
Bronsted-Lowry
Ácido
Doador de H+
Base
Receptor de H+
Ácido Conjugado
Reagente decorrente da base
Base Conjugada
Reagente decorrente do ácido
Força do ácido é inversamente proporcional a base conjulgada formada
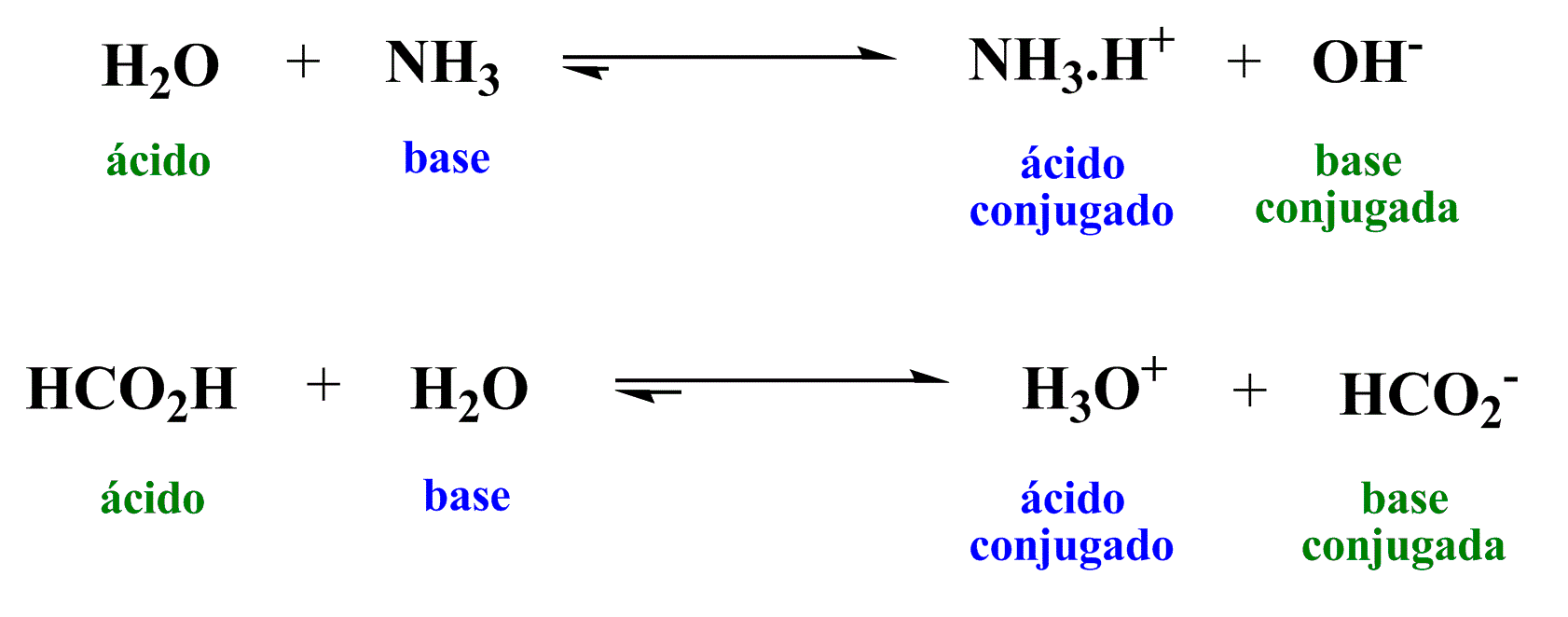
Espécie Anfiprótica ou anfótera
Lewis
Ácido
Recebe par de elétrons
Eletrófilo
Base
Doador de par de elétrons
Nucleófilos
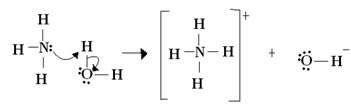
Relação entre as teorias
Lewis>Bronsted>Arrhenius
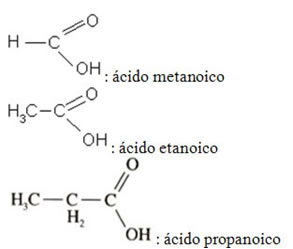
Ácidos
Classificações
Presença de óxigênio
Hidrácidos
sem Oxigênio

Oxiácidos
com Oxigênio
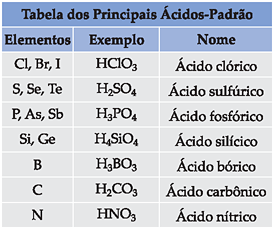
Presença de Carboxila
Orgânico
Inorgânico ou Mineral
Volatilidade
Fixos
Voláteis

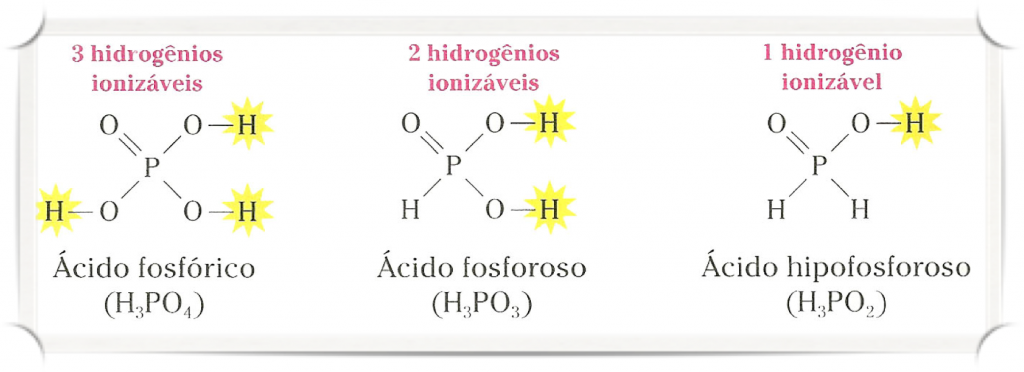
Número de Hidrogênios Ionizáveis

Número de elementos

Hidrogênio ionizável
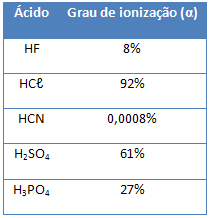
Grau de ionização

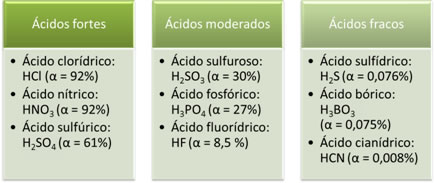
Força dos ácidos

Ionização de Poliácidos
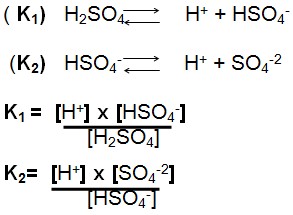
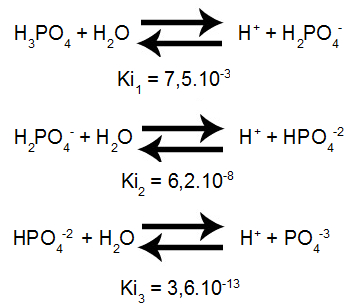
Ácidos e Equilíbrio