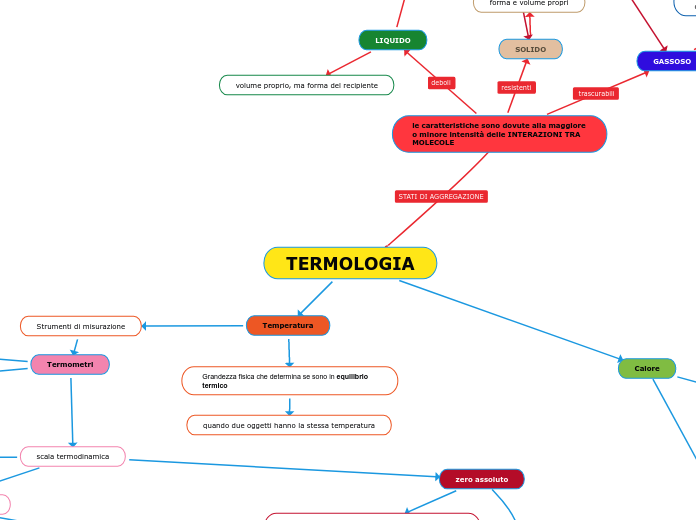
TERMOLOGIA
Temperatura
Grandezza fisica che determina se sono in equilibrio termico
quando due oggetti hanno la stessa temperatura
Strumenti di misurazione
Termometri
sfrutta effetti fisici
la dilatazione che subisce un liquido (alcol o mercurio)
scala termodinamica
due temperature di riferimento
congelamento ed ebollizione
più diffuse Celsius, Fahrenheit, Kelvin
Celsius
0°C, temperatura del ghiaccio
100°C, temperatura ebollizione acqua
zero assoluto, -273,15°C
Fahrenheit
32°C, temperatura del ghiaccio
212°C, temperatura ebollizione acqua
Kelvin
0 K = zero assoluto
1°C = 1 K
T(K)=T(°C) +273,15 T(°C) = T(K) -273,15
zero assoluto
la temperatura minima possibile teorica di un qualsiasi sistema termodinamico.
Gas Ideali
Dipendenza dalla pressione , da temperatura , da numero di molecole e volume
p=costante x T ( volume V costante , numero di Molecole N costante )
p=costante x N ( volume V costante ,temperatura T costante )
pressione di un gas ideale
La pressione di N molecole di gas alla temperatura T e con volume V è p=K (NT/V)
k costante di Boltzmann k=1,38 x 10^-23 J/K
p= costante /V ( numero molecole N costante , temperatura T costante )
Mole
una mole è la quantità di sostanza che contiene tante entità elementari quanti sono gli atomi in 12g di carbonio -12
numero di avogadro , Na = 6,022 x 10^23 molecole/mol
numero di molecole : N=nNA
sostituiamo questa espressione nella relazione p= kNT/V otteniamo P=nNAkT/V= nRT/V
R costante universale dei gas : R= NAK = ( 6,022 x 10^23 molecole / mol ) ( 1,38 x10^-23 J/K) = 8,31 j / (mol K)
equazione di dtato di un gas ideale : PV=nRT
principio di avogadro : volumi uguali di gas differenti , nelle medesime condizioni di temperatura e di pressione contengono lo stesso numero di molecole
leggi dei gas ideali
legge di Boyle
PiVi=pfVf ( numero di moli n costante , temperatufa
leggi di Gay- lussac
prima legge
a pressione costante , volume e temperatura di un gas sono direttamente proporzionali
V=costante x T (p costante )
seconda legge
a volume costante , pressione e temperatura sono direttamente proporzionali p= costante x T ( v costante )
base del funzionamento
La dilazione termica
messo a contatto con il corpo si espande
Dilatazione lineare
ΔT = T - T0
ΔL = L - L0
L0 = lunghezza iniziale
a = coefficiente di dilatazione lineare
ΔL = aL0ΔT = Legge della dilatazione termica
Dilazione volume
ΔV direttamente proposizionale a V0 e ΔT
ß = coefficiente di dilatazione volumica
ΔV = ßV0ΔT = legge della dilatazione termica volumica
Calore
Caloria (cal)
Quantità di calore necessario per innalzare la temperatura di un grammo d'acqua da 14,5°C a 15,5°C
1 cal = 4,186 J
Q = quantità di energia trasferita a causa di una differenza di temperatura
Capacità termica
C = Q/ΔT
J/K
Q = C ΔT
Q>0 si fornisce calore al sistema
Q<0 il sistema cede calore
Legge fondamentale della termologia
Q = m c ΔT
Calore specifico
c = C/m
J/(kg K)
Dipende solo dal tipo di sostanza
Propagazione del calore
Convenzione
Attraverso i fluidi
Conduzione
Flusso di calore che avviene direttamente attravreso un materiale
Q = k A (ΔT/L) t
W/(m K)
Irraggiamento
Energia irradiata sotto forma di onde elettromagnetiche
Potenza irradiata (P)
P = e σ A T^4
Joule nel S.I.
le caratteristiche sono dovute alla maggiore o minore intensità delle INTERAZIONI TRA MOLECOLE
SOLIDO
forma e volume propri
nei solidi cristallini, le molecole formano reticoli geometrici
LIQUIDO
volume proprio, ma forma del recipiente
CAMBIAMENTI DI STATO
Passaggio da uno stato di aggregazione all'altro.
i sistemi che scambiano energia e calore SISTEMI TERMODINAMICI
una parte fisicamente omogenea di un sistema termodinamico è detta FASE
CAMBIAMENTI DI STATO=TRANSIZIONI DI FASE
VAPORIZZAZIONE
passaggio dallo stato liquido a quello di vapore (gassoso) CONDENSAZIONE
EBOLLIZIONE punto in cui la temperatura alla quale la pressione del vapore saturo eguaglia la pressione esterna
FUSIONE o LIQUEFAZIONE passaggio dalla fase solida alla liquida
SOLIDIFICAZIONE
la temperatura alla quale una sostanza passa da solido a liquido è detto PUNTO DI FUSIONE
BRINAMENTO o SUBLIMAZIONE
durante un cambiamento di stato la temperatura di un sistema rimane costante
CALORE LATENTE L di una sostanza è il calore che deve essere fornito o sottratto a una massa unitaria di quella sostanza per farla passare da una fase ad un'altra.
L= Q/m
unità di misuta joule/kilogrammo J/Kg
CALORE LATENTE DI FUSIONE Lf
CALORE LATENTE DI VAPORIZZAZIONE Lv
CALORE LATENTE DI SUBLIMAZIONE Ls
GASSOSO
occupa l'intero spazio del recipiente che lo contiene e ne assume la forma e il volume