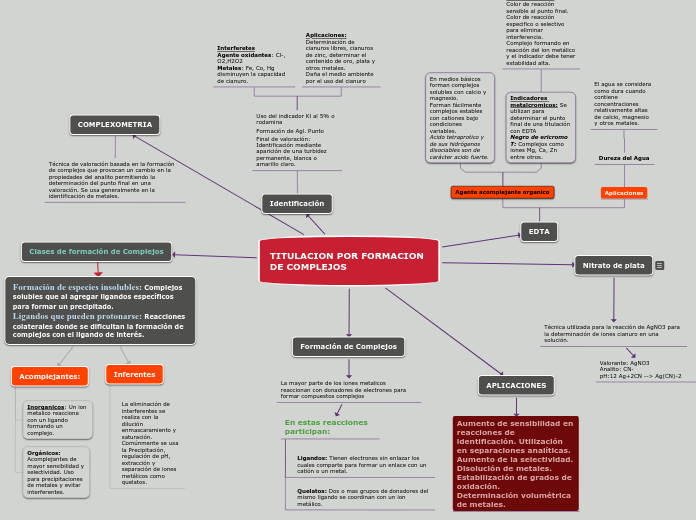
TITULACION POR FORMACION DE COMPLEJOS
APLICACIONES
Aumento de sensibilidad en reacciones de identificación. Utilización en separaciones analíticas. Aumento de la selectividad. Disolución de metales. Estabilización de grados de oxidación. Determinación volumétrica de metales.
COMPLEXOMETRIA
Técnica de valoración basada en la formación de complejos que provocan un cambio en la propiedades del analito permitiendo la determinación del punto final en una valoración. Se usa generalmente en la identificación de metales.
Clases de formación de Complejos
Formación de Complejos
La mayor parte de los iones metalicos reaccionan con donadores de electrones para formar compuestos complejos
En estas reacciones participan:
Ligandos: Tienen electrones sin enlazar los cuales comparte para formar un enlace con un catión o un metal.
Quelatos: Dos o mas grupos de donadores del mismo ligando se coordinan con un ion metálico.
Nitrato de plata
Técnica utilizada para la reacción de AgNO3 para la determinación de iones cianuro en una solución.
Valorante: AgNO3 Analito: CN- pH:12 Ag+2CN --> Ag(CN)-2
Identificación
Uso del indicador Kl al 5% o rodamina Formación de Agl. Punto Final de valoración: Identificación mediante aparición de una turbidez permanente, blanca o amarillo claro.
Interferetes Agente oxidantes: Cl-, O2,H2O2 Metales: Fe, Co, Hg disminuyen la capacidad de cianuro.
Aplicaciones: Determinación de cianuros libres, cianuros de zinc, determinar el contenido de oro, plata y otros metales. Daña el medio ambiente por el uso del cianuro
EDTA
Agente acomplejante organico
En medios básicos forman complejos solubles con calcio y magnesio. Forman fácilmente complejos estables con cationes bajo condiciones variables. Acido tetraprotico y de sus hidrógenos disociables son de carácter acido fuerte.
Indicadores metalcromicos: Se utilizan para determinar el punto final de una titulación con EDTA Negro de ericromo T: Complejos como iones Mg, Ca, Zn entre otros.
Características: Color de reacción sensible al punto final. Color de reacción especifico o selectivo para eliminar interferencia. Complejo formando en reacción del ion metálico y el indicador debe tener estabilidad alta.
Aplicaciones
Dureza del Agua
El agua se considera como dura cuando contiene concentraciones relativamente altas de calcio, magnesio y otros metales.
Formación de especies insolubles: Complejos solubles que al agregar ligandos específicos para formar un precipitado. Ligandos que pueden protonarse: Reacciones colaterales donde se dificultan la formación de complejos con el ligando de interés.
Acomplejantes:
Inorganicos: Un ion metalico reacciona con un ligando formando un complejo.
Orgánicos: Acomplejantes de mayor sensibilidad y selectividad. Uso para precipitaciones de metales y evitar interferentes.
Inferentes
La eliminación de interferentes se realiza con la dilución enmascaramiento y saturación. Comúnmente se usa la Precipitación, regulación de pH, extracción y separación de iones metálicos como quelatos.