por danielle martins 5 anos atrás
666
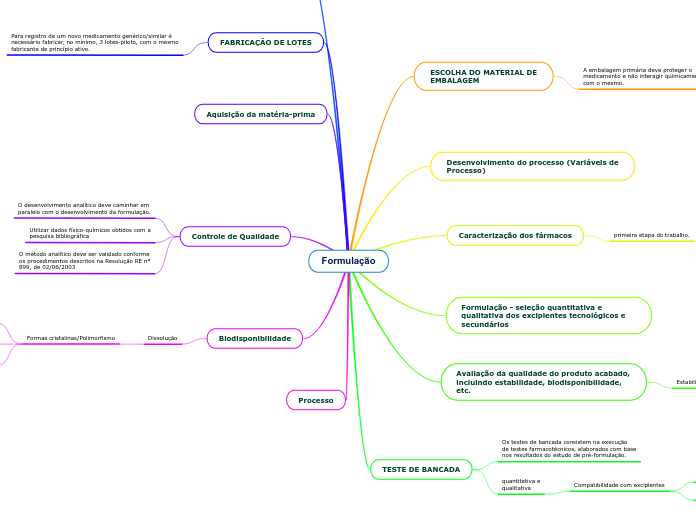
Formulação
por danielle martins 5 anos atrás
666

Mais informações
Higroscopicidade
Impacto na formulação, estabilidade, solubilidade e Biodisponibilidade
Tamanho e formato das partículas
Específicos ou Secundários
Tecnológicos ou primários
Moléculas polares;são pouco absorvidas após administração oral.
Os fármacos lipossolúveis;são normalmente absorvidos após administração oral.